Chemické vlastnosti a reaktivita
Alkeny a cykloalkeny jsou hořlavé látky. Jejich spálením vzniká vodní pára a podle dokonalosti spalování oxid uhličitý, v případě dokonalého spalování, nebo oxid uhelnatý, v případě nedokonalého spalování. V případě nedostatku kyslíku mohou vznikat i saze (uhlík).
-
Dokonalé spalování ethenu: C2H4 + 3 O2 → 2 CO2 + 2 H2O
-
Nedokonalé spalování ethenu: C2H4 + 2 O2 → 2 CO + 2 H2O
-
Spalování s nedostatkem kyslíku: C2H4 + O2 → 2 C + 2 H2O
Uhlíky dvojné vazby jsou v hybridním stavu sp2; atomy uhlíku dvojné vazby a na nich vázané atomy jsou planární částí molekuly alkenu. Dvojná vazba znemožňuje otáčení, takže má-li molekula na rozdílných uhlíkových atomech dvojné vazby různé substituenty, tyto substituenty mohou být orientovány cis nebo trans.
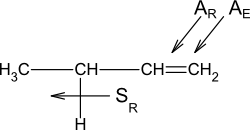
Pokud máme více než dva substituenty, užívá se k popisu stereochemie označení E (z něm. entgegen = proti) a Z (z něm. zusammen = společně), kdy podle priority funkčních skupin určíme jejich polohu. V podstatě jde o rozšíření systému trans a cis.


V molekule se může vyskytovat také více násobných vazeb. Podle jejich polohy rozlišujeme tyto typy:
-
kumulované
H2C=C=CH2
-
konjugované
CH2=CH-CH=CH2
-
izolované - 2 vazby jsou od sebe vzdáleny dál než o jeden uhlík, a tak se vzájemně neovlivňují
CH3-CH=CH-CH2-CH=CH2
Elektrony π vazby jsou mnohem pohyblivější než elektrony σ vazby a díky tomu dochází u nesymetrické molekuly k polarizaci vazby. Záleží na substituentu, zda elektrony dodává či odebírá. Navíc vazba π má nižší disociační energii než vazba σ, a tudíž je reaktivnější. Toto vše je důvod, proč na dvojné vazbě přednostně dochází k mnoha reakcím.