Elektrofilní adice
Alkeny se chovají jako nukleofily. Dvojná vazba je bohatá na elektrony, a proto může elektrofilu v polárních reakcích poskytnout elektronový pár. V polárním prostředí dochází k heterolytickému štěpení látky, která se aduje tzn. že molekula se může rozdělit na kladně a záporně nabitou část.
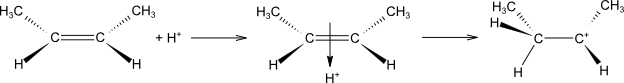
Adice je iniciována elektrofilem.
-
činidlo se heterolyticky rozštěpí na elektrofil a nukleofil

-
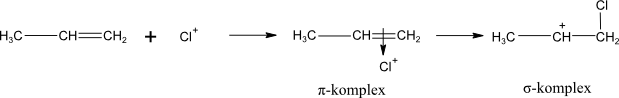
elektrofil se naváže na dvojnou vazbu za vzniku π-komplexu a následně karbokationtu
-
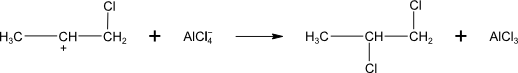
na karbokation se naváže nukleofil
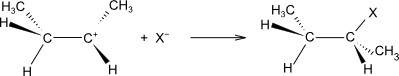
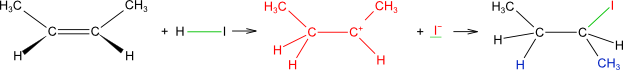
Reakce alkenů s halogenovodíky
Elektrofil H+ je přitažen π-elektrony dvojné vazby a vzniká π-komplex, který přechází následně v novou σ-vazbu; druhý atom uhlíku tak získává kladný náboj. Nukleofil I− poskytuje elektronový pár kladně nabitému atomu uhlíku za vzniku nové σ-vazby C-I a vzniká produkt adice.
Stabilita karbokationtů:

Stabilita je způsobena kladným indukčním efektem, který způsobuje kompenzaci kladného náboje. Čím více jich je na uhlíku, který nese kladný náboj, tím menší je nedostatek na tomto atomu - tím je karbokation stabilnější. Je-li v sousedství zdroj pohyblivých π-elektronů (aromatický systém, dvojná vazba), je stabilizace ještě výraznější. Z tohoto důvodu jsou karbokationty allylového a benzylového typu stabilnější, přestože jsou primární.
Allylový kation je stabilní stejně jako sekundární karbokation a kation benzylového typu je stejně stabilní jako terciární karbokation.
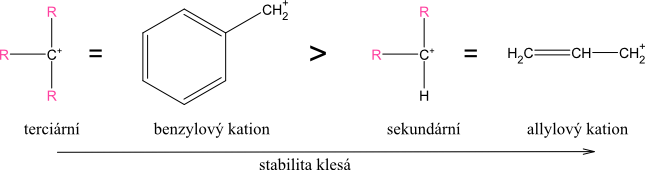
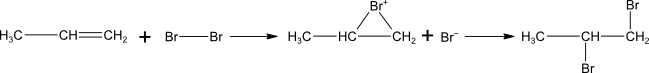
Reakce alkenů s halogeny
-
Probíhá stejným mechanismem jako adiční reakce s halogenovodíky.
-
vyžaduje přítomnost Lewisovy kyseliny (AlCl3, SnCl4, …)
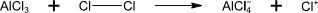
Adice vody v kyselém prostředí
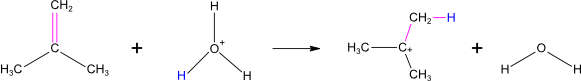

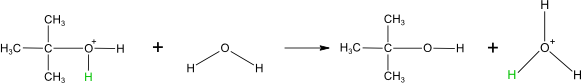
Všechny tyto adice jsou tzv. trans adice. To znamená, že nově se vázající substituenty jsou vůči sobě v poloze trans.