Fyzikální vlastnosti
Alkoholy jsou bezbarvé látky, lehčí než voda. Vazby mezi jejich atomy C, O a H jsou polarizované.
Alkoholy mají relativně vysoké teploty varu ve srovnání s odpovídajícími uhlovodíky, což je způsobeno tím, že stejně jako molekuly vody vytváří v kapalném stavu mezi svými molekulami vodíkové můstky. Atom vodíku hydroxylové skupiny je kladně polarizovaný a je přitahován k volným elektronovým párům záporně polarizovaného atomu kyslíku další molekuly alkoholu. Vznikají tak vodíkové vazby, které jednotlivé molekuly poutají navzájem k sobě. Při přechodu do plynného stadia je pak nutné tyto síly překonat, čímž dojde ke zvýšení teploty, potřebné k dosažení bodu varu.
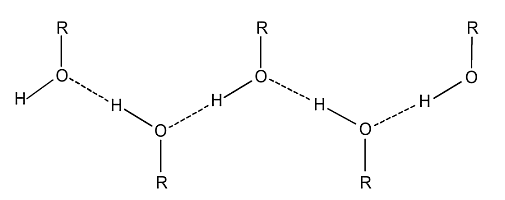
Rozpustnost alkoholů ve vodě ovlivňuje délka jejich uhlovodíkového řetězce. Nižší alkoholy jsou těkavé kapaliny s narkotickými účinky a lze je neomezeně mísit s vodou. Jejich rozpustnost ulehčují vodíkové můstky, které byly již vzpomenuty.
Rozpustné alkoholy s vodou vytvářejí azeotropickou směs. Teplota varu azeotropické směsi je vždy nižší než teplota varu příslušného bezvodého alkoholu. Z tohoto důvodu nelze připravit prostou destilací absolutně čistý alkohol.
Alkoholy s delším uhlovodíkovým řetězcem jsou ve vodě nerozpustné, některé z nich i pevné látky. Všechny alkoholy jsou rozpustné v polárních rozpouštědlech. Samy bývají často používány jako dobrá rozpouštědla barviv, pryskyřic a dalších látek.