Acidobazické vlastnosti
Alkoholy mají amfoterní charakter. Vykazují chemické vlastnosti slabých kyselin i slabých bazí, podobně jako voda.
| Příslušný alkohol | pKa |
|---|---|
| 2-methylpropan-2-ol | 18,00 |
| propan-2-ol | 17,00 |
| ethanol | 16,00 |
| voda | 15,74 |
| methanol | 15,54 |
| ethan-1,1- diol | 13,60 |
Bazické vlastnosti alkoholů jsou způsobeny přítomností dvou volných elektronových párů na kyslíku hydroxylové skupiny. Při styku alkoholu se silnými kyselinami může proběhnout reversibilní protonace alkoholu na oxoniový ion ROH2+, což je reakce typická pro bazické sloučeniny.
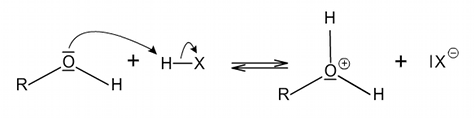
Kyselý charakter molekule dodává polární vazba mezi vodíkem a kyslíkem hydroxylové skupiny. Ve zředěných vodných roztocích tak dochází stejně jako u kyselin k disociaci molekul na ion H3O+ a alkoxidový aniont RO−.
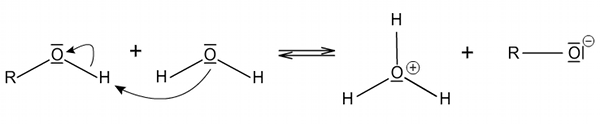
Kyselost alkoholů silně ovlivňuje jejich uhlovodíkový zbytek, což vedle elektronového vlivu, způsobuje zejména solvatace alkoxidových iontů vzniklých disociací. Pokud je hydroxylová skupina stíněná alkylovými substituenty, probíhá solvatace obtížně a alkoxidový ion je málo stabilní. Naopak u alkoholu s málo stíněnou hydroxylovou skupinou je kyslík dobře přístupný, vzniklý alkoxidový ion je stabilnější a jeho vznik je energeticky výhodnější.