Acidobazické vlastnosti
Fenoly jsou, stejně jako alkoholy, amfoterní látky. Jsou však přibližně milionkrát kyselejší než alkoholy, což je způsobeno možnou rezonanční stabilizací – delokalizací náboje fenoxidového aniontu na aromatickém jádru. Záporný náboj je pak rozložen tak, že relativní zvýšení elektronové hustoty je v ortho- a para- polohách jádra.
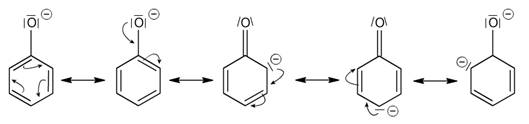
Kyselost fenolů může být dále umocňována elektronakceptorními substituenty (např. nitroskupinami). Naopak elektrondonorní substituenty kyselost snižují. Nejvíce ovlivňují acidobazické vlastnosti substituenty v polohách 2, 4 a 6, mezi které je záporný náboj fenoxidového aniontu rozložen.
| Vybraný fenol | pKa |
|---|---|
| p-aminofenol | 10,46 |
| p- methoxyfenol | 10,21 |
| p-methylfenol | 10,17 |
| fenol | 9,89 |
| p-chlorfenol | 9,38 |
| p-bromfenol | 9,35 |
| p-nitrofenol | 7,15 |
| 2,4,6-trinitrofenol | 0,60 |
Díky větší kyselosti fenolů, oproti alkoholům, je možná příprava fenolátů ve vodných roztocích (např. reakcí s vodným roztokem alkalického hydroxidu).