Chemické vlastnosti
Přítomnost volného elektronového páru charakterizuje vlastnosti aminové skupiny. Díky němu jsou aminy bázemi i nukleofily.
Aminy jsou méně bazické než alkalické hydroxidy, ale mnohem bazičtější než alkoholy, ethery nebo voda. Pokud rozpouštíme amin ve vodě, ustaví se rovnováha - voda se v této rovnováze chová jako kyselina, která poskytuje proton. Vytváří se amoniová sůl.
Konstanta bazicity aminu:
Konstanta acidity amoniového iontu:

Z toho vyplývá: Čím vyšší je pKa amoniového iontu, tím silnější bází je amin a naopak.
U alifatických aminů bazicita v řadě primární – sekundární – terciární nejprve stoupá, pak klesá. Sekundární aminy jsou nejbazičtější.
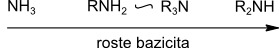
Aromatické aminy (pKa je okolo 4) jsou méně bazické než alifatické (pKa je přibližně 10). Je to způsobeno zapojením volného elektronového páru dusíku s aromatickým jádrem. Tím pádem se elektroný pár navázaný na dusíku stává hůře přístupným.
Bazicitu ovlivňují i navázané substituenty, které se dělí na aktivující skupiny (zesilují bazické vlastnosti) a deaktivující skupiny (zeslabují bazicitu).
| Z | pKa | ||
|---|---|---|---|
![[figure]](images/anilin_obecny.png)
obecná struktura aromatických aminů |
–NH2 | 6,15 | aktivující skupiny |
| –OCH3 | 5,34 | ||
| –CH3 | 5,08 | ||
| –H | 4,63 | ||
| –Cl | 3,98 | deaktivující skupiny | |
| –Br | 3,86 | ||
| –CN | 1,74 | ||
| –NO2 | 1,00 |
| sloučenina | pKa |
|---|---|
| NH3 | 9,26 |
| methylamin | 10,66 |
| ethylamin | 10,81 |
| dimethylamin | 10,73 |
| trimethylamin | 9,81 |
| pyrrolidin | 11,27 |