Za počátek získávání chemických poznatků lze považovat první zkušenosti pralidí s ohněm. Uplynula ovšem tisíciletí, než člověk oheň použil k vypalování hliněných nádob a další stovky let, než se naučil vytavovat kovy z rud.
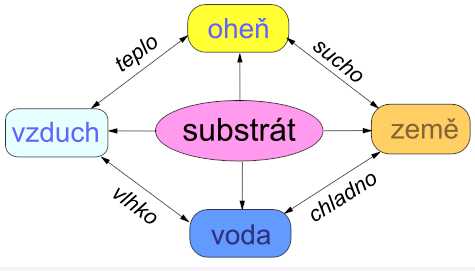
Počátek soustavného rozvoje chemie připadá na období přechodu mezi prvobytně-pospolnou a otrokářskou společností. Původní názory na svět vycházely z představy, že vznikl z jediné pralátky. Thales z Milétu (7. až 6. stol. př. n. l.) soudil, že látky jsou tvořeny vlastnostmi. Za základní vlastnosti pokládal antagonistické dvojice teplo/chlad a sucho/vlhko, jejichž kombinacemi pak vznikaly čtyři živly – vzduch, oheň, voda a Země. Jeho přístup byl rozvinut Empedoklem (5. stol. př. n. l.) a Aristotelem (4. stol. př. n. l.), který přidal pátý živel – všepronikající ether. Již sto let před Aristotelem byl vysloven z dnešního hlediska realitě mnohem bližší názor, že látky se skládají z malých, dále nedělitelných částic – atomů (Demokritos, 450 let př. n. l.). Různé vlastnosti látek pak byly přisuzovány jejich různému tvaru (železo hranaté, voda kulaté atomy). Prosazení tohoto přístupu po mnoho staletí zabránila Aristotelova autorita.
V 1. století n. l. se chemické studium soustřeďovalo do Egypta (v té době vznikl název chýmia), v 7. století n. l. převzali úlohu průkopníků Arabové (Avicena, Geber), kteří změnili i název discipliny na alchymie. Zájem se v té době soustřeďoval na transmutaci kovů (výrobu zlata z neušlechtilých kovů) a největší překážkou rozvoje chemie byl mysticismus spojený s utajováním získaných poznatků. Do tohoto období spadá vznik sulfo-merkuriové teorie, v níž síra byla reprezentantem nekovových a rtuť kovových vlastností. Vzájemný poměr obou těchto komponent ve sloučeninách pak určoval jejich vlastnosti a chování. Ve 14. století se do popředí zájmu alchymistů dostala výroba elixíru života, což znamenalo pokračování cesty chemického poznání slepou uličkou. Obrat správným směrem ve vývoji chemie nastal až v 16. století. Je spojen především se jmény T. Paracelsus (švýcarský lékař, zavedl název iatrochemie a definoval její úkol jako službu lidem s důrazem na příprava léků jako pomoci trpícím) a G. Agricola (metalurgické postupy).
V 17. století se začínají rozvíjet technologie výrob anorganických sloučenin (J. R. Glauber) a hlavní důraz se při chemickém studiu začíná klást na experiment (R. Boyle – „nullis in verba“). Vzniká flogistonová teorie (P. Becher, flogiston – fluidum hořlavosti – byl komplikovaně spojován s vodíkem), která na jedno století ovládla chemii. Její vyvrácení je spojeno především se jmény A. L. Lavoisiera a M. V. Lomonosova (zákon zachování hmoty, důraz na kvantitativní údaje, seznam chemických prvků, názvosloví). Pro následující období je charakteristické podstatné zrychlení shromažďování chemických poznatků (začátek diferenciaci chemie na jednotlivé discipliny) a vybudováním teoretických základů chemie. To umožnilo D. I. Mendělejevovi formulovat periodický zákon představující dnes ústřední princip chemie.
Historické mezníky poznání periodického zákona jsou uvedeny v následujícím přehledu:
Tabulka 1.1. Historie
| L. B. G. deMorveau | 1772 | tabulka chemicky jednoduchých látek |
| J. W. Döbereiner | 1817-1829 | pojem triády |
| L. Gmelin | 1843 | uvádí 16 triád |
| J. B. Dumas | 1857 | tabulka 32 prvků v 8 sloupcích |
| A. E. B. de Chancourtois | 1864 | prvky podle atomových hmotností na šroubovici |
| W. Odling | 1864 | tabulka 57 prvků v 17 sloupcích |
| L. Mayer | 1864, 1868 | tabulka 49 prvků, křivka atomových objemů |
| D. I. Mendělejev | 1869-1871 | periodický zákon, předpověď deseti prvků |
| J. W. Rayleigh, W. Ramsay | 1894-1898 | objev vzácných plynů |
| J. J. Thompson | 1896 | objev elektronu |
| N. Bohr | 1913 | zdůvodnění počtu lanthanoidů (14) |
| H. G. J. Moseley | 1913 | pojem atomového čísla |
| E. McMillan, P. Abelson | 1940 | první transuran (93Np) |
| G. T. Seaborg | 1944 | aktinoidová hypotéza (ekvivalent lanthanoidů) |