Hydridy MH vznikají reakcí alkalického kovu s vodíkem (LiH při 600 °C, NaH už při 300 °C)
2 M + H2 → 2 M+H–
Termická stabilita těchto krystalických pevných látek klesá a chemická reaktivita naopak vzrůstá od lithia k cesiu. Hydrid lithný LiH se využívá v přenosných zdrojích vodíku a je výchozí látkou pro přípravu hydridohlinitanu lithného LiAlH4
4 LiH + AlCl3 → LiAlH4 + 3 LiCl
Termicky se rozkládá až nad bodem tání (692 °C, částečný rozklad nastává už při nižší teplotě – rovnovážný disociační tlak vodíku při 550 °C je 1,33 kPa). Hydrid sodný NaH se používá při syntéze diboranu a hydroboratu sodného
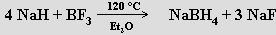
Hydridy rubidný RbH a cesný CsH jsou samozápalné i na suchém vzduchu.
Acetylidy M2C2 vznikají reakcí kovu s acetylenem, pouze lithium poskytuje acetylid lithný Li2C2 reakcí s uhlíkem při zvýšené teplotě. Jsou známy rovněž hydrogenacetylidy alkalických kovů MHC2. Všechny jsou vysoce reaktivní, vodou se prudce rozkládají. Hydrogenacetylid lithný LiC2H je surovinou při výrobě vitaminu A.
Přímou reakcí lithia s dusíkem vzniká už za laboratorní teploty nitrid lithný Li3N. Nitridy ostatních alkalických kovů se připravují rozkladem příslušných azidů nebo účinkem elektrického výboje na směs par příslušných prvků. Za vhodných podmínek lze z nitridu lithného a vodíku připravit hydrid lithný a opačně z hydridu lithného a dusíku nitrid lithný (meziprodukty jsou amid a imid lithný). Amidy MNH2 vznikají pozvolným rozkladem roztoků alkalických kovů v kapalném amoniaku.
M + NH3 → MNH2 + H2
Imid lithný Li2NH je jediný známý imid alkalického kovu.

Fosfidy alkalických kovů nemají iontový charakter. Se sodíkem tvoří fosfor stechiometrický (Na3P) a fosforem bohatý (Na3P11) fosfid.
Oxidy M2O, peroxidy M2O2, hyperoxidy MO2 a ozonidy MO3 jsou známy u všech alkalických kovů. Hořením lithia vzniká oxid, sodíku peroxid a u draslíku, rubidia a cesia hyperoxidy. To odpovídá zvyšující se intenzitě elektrostatického pole v řadě od cesia k lithiu umožňující maximálně stabilizovat aniont O2− kationty K+, Rb+ a Cs+, O22− kationtem Na+ a O2− kationtem Li+.
Oxidy M2O (M = Na, K, Rb, Cs) je možno připravit redukcí dusičnanů nebo dusitanů příslušným alkalickým kovem
M2O2 + 2 M → 2 M2O
2 MNO3 + 10 M → 6 M2O + N2
Peroxidy M2O2 lze považovat za soli peroxidu vodíku a jejich reakce s vodou je využitelná k jeho přípravě
M2O2 + 2 H2O → 2 MOH + H2O2
Peroxid sodný Na2O2 se používá jako bělicí prostředek. V technické praxi se reakcí směsi peroxidu sodného a chlornanu vápenatého s vodou uvolňuje kyslík.
Hyperoxidy MO2 jsou barevné (KO2 žlutý, RbO2 tmavohnědý a CsO2 žlutooranžový) paramagnetické látky, strukturně analogické acetylidu vápenatému CaC2.
Jejich opatrným termickým rozkladem lze připravit tmavě zbarvené paramagnetické seskvioxidy M2O3, které jsou považovány za peroxid-dihyperoxidy [(M+)4 (O22−)(O2−)2]. Hyperoxid lithný LiO2, který byl izolován v inertní matrici při 15 K, se rozkládá již při -33 °C. Vodou se hyperoxidy rozkládají za vzniku peroxidu vodíku, příslušného hydroxidu a dikyslíku. Kyslík vzniká i reakcemi peroxidů nebo směsí peroxidu a hyperoxidu s oxidem uhličitým (hyperoxid draselný KO2 se používá v dýchacích přístrojích)
Na2O2 + CO2 → → Na2CO3 + 1/2 O2
Na2O2 + KO2 + 2 CO2→ Na2CO3 + K2CO3 + 2 O2
Ozonidy MO3 (červené) lze extrahovat kapalným amoniakem z produktů reakce ozonu s bezvodými hydroxidy alkalických kovů za nízké teploty. U lithia tak vzniká ozonid tetraamminlithný [Li(NH3)4]O3 (amoniak z něho nelze bez rozkladu odstranit).
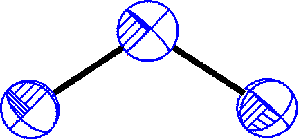 | 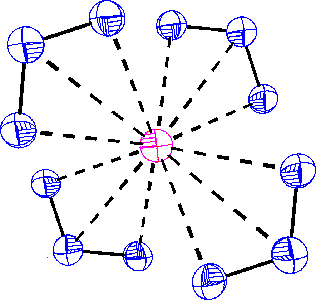 |
Struktura aniontu O3– | Struktura KO3 |
Stáním za laboratorní teploty se ozonidy rozkládají na hyperoxidy a kyslík.
MO3→ MO2 + 1/2 O2
Jejich hydrolýza poskytuje vedle dikyslíku příslušné hydroxidy
4 MO3 + 2 H2O → 4 MOH + 5 O2
Kromě oxidů, v nichž je oxidační číslo alkalického kovu +I, jsou u rubidia a cesia známy suboxidy s neceločíselným formálním oxidačním číslem. Parciální oxidací rubidia za nízké teploty lze získat Rb6O, který se při -7,3 °C rozkládá na měděně zbarvené krystaly Rb9O2 tvořené dvojicemi oktaedrů ORb6 sdílejícími společnou plochu (přebytek pěti elektronů nad normální stechiometrii způsobuje, že Rb9O2 má charakter kovu). Nejširší paletu binárních sloučenin s kyslíkem poskytuje cesium (celkem devět o složení mezi Cs7O a CsO3). Cs7O přesněji popisuje vzorec [(Cs11O3)Cs10]. Jednotky Cs11O3 jsou tvořeny třemi oktaedry OCs6 spojenými vzájemně plochami, zbývající atomy cesia tvoří řetězce uložené mezi nimi.
Sulfidy M2S lze připravit přímou syntézou z prvků. Jsou dobře rozpustné ve vodě, roztoky v důsledku hydrolýzy reagují alkalicky. Vzdušným kyslíkem se snadno oxidují na thiosírany. Nejběžnější ze sulfidů je sulfid disodný Na2S a z hydrogensulfidů hydrogensulfid draselný KHS. Varem roztoků sulfidů se sírou se tvoří polysulfidy M2Sn (maximální hodnota n je dvě pro lithium, pět pro sodík a šest pro draslík, rubidium a cesium).
Halogenidy alkalických kovů jsou bezbarvé krystalické látky o složení MX. S výjimkou halogenidů lithných mají výrazně iontový charakter a tomu odpovídající vysoké body tání a varu. Páry se skládají z iontových párů M+X−.

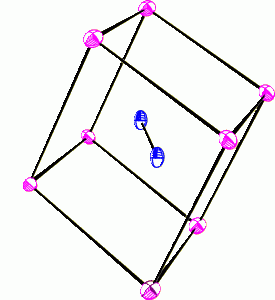
Halogenidy lithné s výjimkou fluoridu jsou na vzduchu rozplývavé látky rozpustné ve vodě i v organických rozpouštědlech. Chlorid lithný LiCl tvoří dihydrát, monohydrát chloridu sodného NaCl je stálý pouze při teplotě nižší než 0,15 °C (rozpustnost NaCl ve vodě je velmi málo závislá na teplotě – 35,6 g NaCl při 0 °C a 39,1 g při 100 °C ve 100 g vody) a chloridy zbývajících alkalických kovů hydráty netvoří. Chloridu sodného se spotřebují miliony tun ročně v mnoha odvětvích těžkého anorganického průmyslu. Všechny halogenidy alkalických kovů krystalují v mřížce typu NaCl, pouze struktura halogenidů cesných je odlišná (typ CsCl). Existují rovněž polyhalogenidy o složení MXn (trijodid draselný KI3 krystaluje jako monohydrát a vzniká rozpouštění m jodu v roztoku jodidu draselného).
Termodynamicky možná a dokonce exotermická by byla reakce
Cs (s) + F2 (g) → CsF2 (s); ΔH0 = -125 kJ.mol-1
Ovšem vzhledem k výrazné energetické výhodnosti tvorby fluoridu cesného
Cs (s) + 1/2 F2 (g) → CsF (s); ΔH0 = – 530 kJ.mol-1
by se potenciálně vznikající fluorid cesnatý ihned rozkládal
CsF2 (s) → CsF (s) + 1/2 F2 (g); ΔH0 = – 405 kJ.mol-1
Hydroxidy alkalických kovů jsou bezbarvé, silně hygroskopické, leptavé, snadno tavitelné (body tání klesají od 471 °C pro LiOH na 272 °C u CsOH), ve vodě i v ethanolu dobře rozpustné látky. Jsou to agresivní, silně korozívní sloučeniny, které leptají i sklo a porcelán (v přítomnosti kyslíku v žáru poškozují i platinu), v roztocích představují nejsilnější známé baze. Taví se v železných, niklových, stříbrných nebo zlatých nádobách. Výjimkou je hydroxid lithný LiOH, který je ve vodě i v ethanolu málo rozpustný, z vodného roztoku krystaluje jako monohydrát (vzájemně propojené tetraedrické útvary s atomem lithia ve středu a dvěma skupinami OH− a dvěma molekulami vody ve vrcholech). Mimořádný praktický význam mají hydroxidy sodný NaOH (zpracování bauxitu, výroba chlornanu sodného) a draselný KOH. Vyrábějí se elektrolýzou roztoků chloridů, nejčastěji s využitím rtuťové katody. Na ní se v důsledku přepětí vodíku vylučuje alkalický kov a vzniká amalgám, z něhož lze působením vody získat velmi čistý roztok pří slušného hydroxidu
2 M + H2O → 2 MOH + H2

Příprava alkalických hydroxidů reakcí uhličitanů s hydroxidem vápenatým (kaustifikace) je v současnosti již technicky nevýznamná s výjimkou výroby LiOH
Li2CO3 + Ca(OH)2→ CaCO3 + 2 LiOH
Ze solí oxokyselin jsou nejvýznamnější uhličitany, dusičnany a sírany. Jsou známy všechny uhličitany a hydrogenuhličitany alkalických kovů mimo hydrogenuhličitanu lithného LiHCO3. S výjimkou uhličitanu lithného Li2CO3 a hydrogenuhličitanu sodného NaHCO3 jsou dobře rozpustné ve vodě a všechny uhličitany alkalických kovů lze bez rozkladu tavit. V pevném stavu je možno získat bezvodé soli i hydráty (Na2CO3.10H2O).
Uhličitan sodný Na2CO3 (soda) se v průmyslovém měřítku připravuje dvěma metodami. Leblancův způsob (dnes se již nepoužívá, hlavní nevýhodou jsou obtíže se zpracováním odpadního CaS) je založen na redukci síranu sodného uhlíkem a následné konverzi sulfidu sodného vápencem
Na2SO4 + 2 C→ Na2S + 2 CO2
Na2S + CaCO3→ Na2CO3 + CaS
Při Solvayově metodě se roztok chloridu sodného (solanka) sytí nejprve amoniakem a potom oxidem uhličitým, čímž vzniká anion hydrogenuhličitanový. Z roztoku se nevylučuje jeho amonná sůl, ale v důsledku menší rozpustnosti hydrogenuhličitan sodný (jedlá soda)
NH3 + H2O + CO2→ NH4HCO3
NaCl + NH4HCO3→ NaHCO3 + NH4Cl
Po izolaci se NaHCO3 termicky rozkládá (kalcinuje) na bezvodý uhličitan sodný (odpadním produktem je v tomto případě chlorid vápenatý vznikající při regeneraci amoniaku z chloridu amonného). Především v USA je pro výrobu sody stále významnější těžba přírodní trony.
Uhličitan draselný K2CO3 (potaš) se připravuje Engelovou metodou, při níž se oxid uhličitý zavádí do suspenze trihydrátu uhličitanu hořečnatého v roztoku chloridu draselného. Z roztoku se vylučuje MgCO3.KHCO3.4H2O, který se při 60 °C ve vodě rozkládá
2 MgCO3.KHCO3.4 H2O → K2CO3 + 2 MgCO3.3 H2O + H2O
Dusičnany MNO3 jsou snadno tavitelné a dobře rozpustné ve vodě. Připravují se převážně neutralizací kyseliny dusičné příslušným hydroxidem, možná je i podvojná záměna
NaNO3 + KCl→ NaCl + KNO3
Zahříváním se rozkládají na dusitany a kyslík (termická stabilita roste s rostoucí atomovou hmotností kationtu)
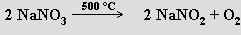
při vyšších teplotách až na oxid kovu, dusík a kyslík
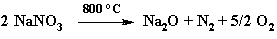
Dusičnany sodný NaNO3 i draselný KNO3se používají jako průmyslová hnojiva, oxidovadla, solné lázně. Dusičnan lithný LiNO3 se uplatňuje v pyrotechnice.
Dusitany MNO2 jsou bílé krystalické hygroskopické látky, velmi dobře rozpustné ve vodě. Vznikají redukcí dusičnanů (olovem nebo uhlíkem)
NaNO3 + Pb → NaNO2 + PbO
Průmyslově se připravují zaváděním oxidů dusíku do roztoku sody
Na2CO3 + NO + NO2→ 2 NaNO2 + CO2
Využívají se k výrobě azobarviv, jako inhibitory koroze a ke konzervování masa.
Sírany M2SO4 i hydrogensírany MHSO4 jsou dobře rozpustné ve vodě, nepatrně v organických rozpouštědlech. Hydrogensírany termicky kondenzují za vzniku disíranů M2S2O7, které při zahřívání odštěpují oxid sírový, a v tavenině mají proto schopnost rozkládat některé těžce rozpustné kovové oxidy. Síran sodný Na2SO4 se používá k rozpouštění ligninu v papírenském průmyslu (zhruba 70 % produkce), ve sklářství a k výrobě detergentů.
Organokovové sloučeniny byly intenzivně studovány převážně u tří nejlehčích alkalických kovů. Iontový charakter vazeb a tím i reaktivita těchto látek rostou se zvyšujícím se atomovým číslem alkalického kovu. Jsou nestálé na vzduchu, nepříliš rozpustné v organických rozpouštědlech a snadno podléhají hydrolýze. Známy jsou alkyl- i arylsloučeniny. Oligomerní alkyllithné sloučeniny, které mají největší význam, lze snadno připravit reakcí lithia s alkylchloridy v inertním rozpouštědle (petrolether, benzen, diethylether) za vyloučení přístupu vzdušného kyslíku a vlhkosti
2 Li + RX→ LiR + LiX (R = alkyl)
Tetramerní methyllithium (LiCH3)4 obsahuje klastr Li4C4 tvořený tetraedrem Li4, nad jehož plochami jsou umístěny jako η3-můstky atomy uhlíku. Ethyllithium (LiC2H5)4 je v pevném stavu rovněž tetramerní, v uhlovodících se rozpouští na hexamer. LiCH3 a LiBun se pro použití v organické syntéze vyrábějí v tunových množstvích. Arylsloučeniny lze výhodně připravit reakcí
LiBun + ArI → LiAr + BunI
Výměnou kovů se získávají deriváty nenasycených organických skupin (vinyl, allyl)
4 Li(C6H5) + Sn(CH=CH2)4→ Li–CH=CH2 + Sn(C6H5)4
Velmi často jsou kationty alkalických kovů elektropozitivní složkou komplexních solí. Ionty alkalických kovů mají v důsledku malého náboje a velkého rozměru poměrně slabé koordinační schopnosti, které klesají v řadě Li > Na > K > Rb > Cs. Soli alkalických kovů tvoří četné hydráty, sklon k tvorbě amminkomplexů je, s výjimkou lithia, malý.
Cheláty alkalických kovů s β-diketony a salicylaldehydem (1925, N. Sidgwick) nejsou příliš stabilní, stálejší jsou komplexy s makrocyklickými polyethery (crownethery, C. J. Padersen, 1967). Zájem o tyto látky pramení především z možnosti modelování funkce přírodních makrocyklických antibiotik (valinomycin, monoaktin) a částečného vysvětlení pozoruhodné selektivity využití sodíku a draslíku v biologických systémech.
Zajímavé jsou i strukturní aspekty těchto sloučenin, v nichž se uplatňují neobvyklá koordinační uspořádání (pentagonální pyramida, nesymetrická uspořádání s koordinačními čísly 7 a 8). Dobré chelatační schopnosti vůči kationtům alkalických kovů mají i chobotnicové ligandy, t.j. deriváty benzenu se dvěma až šesti merkaptopolyetherovými skupinami C6H6-nRn(R = -SC2H4OC2H4OCH3). Nejúčinnějšími ligandy se ukázaly makrobicyklické kryptáty (v komplexu [Rb(krypt)]SCN.H2O (krypt = N{(CH2CH2O)2CH2CH2}3N) je kation rubidný obklopen ligandem a šest donorových atomů kyslíku vytváří kolem něho trigonální hranol). Sloučeniny tohoto typu se uplatňují při extrakcích a při stabilizaci neobvyklých oxidačních stavů kovů. Sodík reaguje s kryptátem (v přítomnosti ethylaminu) za tvorby sodidové soli (obecně jsou sloučeniny tohoto typu nazývány alkalidy, rentgenová strukturní analýza potvrdila, že anion Na− představuje ve struktuře separovanou částici)
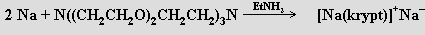
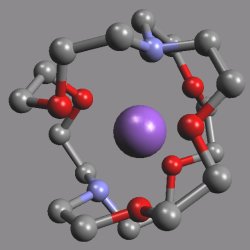
Charakter kryptátů mají i některé anorganické ligandy (u heteropolywolframanu (NH4)17Na[NaW21Sb9O86].14 H2O byla zjištěna antivirová aktivita).