Uhlovodíky (binární sloučeniny uhlíku s vodíkem) studuje organická chemie. Nemají ani výrazně kyselé ani zásadité vlastnosti, vůči kyselinám i hydroxidům jsou vysoce odolné. Podle počtu uhlíkových atomů v molekule jsou plynné, kapalné i pevné. Hlavním zdrojem nasycených uhlovodíků je ropa a zemní plyn, nenasycených kamenouhelný dehet. Plynné uhlovodíky mají význam jako paliva, kapalné jako pohonná směs do výbušných motorů.
Karbidy jsou binárními sloučeninami uhlíku s elektropozitivnějšími prvky. Připravují se reakcí kovů nebo jejich oxidů s uhlíkem (2 000 °C) nebo s uhlovodíky (karbidy alkalických kovů lze připravit i jejich reakcemi s acetylenem v kapalném amoniaku). Podle převažujícího typu vazby se dělí do čtyř skupin.
Většina iontových karbidů obsahuje acetylidové anionty C22−, a lze je proto považovat za soli acetylenu. Připravují se reakcemi kovů nebo jejich oxidů s uhlíkem nebo acetylenem, který reakcí s vodou opět poskytují. Kovy v nich mohou vystupovat v oxidačních stavech +I až +III (M2C2, MC2 a M2(C2)3). Strukturně k tomuto typu patří i Mg2C3, při jehož rozkladu vodou vzniká propyn (methylacetylen). Pouze formálně sem náležejí karbidy M2C2 (M = CuI, AgI, AuI) a MC2 (M = ZnII, CdII, HgII), které se vodou nerozkládají a vazebné interakce v nich mají převážně kovalentní charakter. Jsou známy i hydrogenacetylidy alkalických kovů MHC2.
Karbid vápenatý CaC2 se připravuje reakcí páleného vápna s koksem
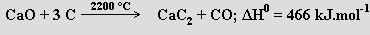
a může být využit jako zdroj acetylenu
CaC2 + 2 H2O → C2H2 + Ca(O)2; ΔH0 = -120 kJ.mol-1
i jako surovina pro výrobu kyanamidu vápenatého CaCN2 (hnojivo, které se v půdě vhodnou rychlostí rozkládá přes kyanamid NH2CN a močovinu CO(NH2)2 na amoniak)
CaC2 + N2 → CaCN2+ C; ΔH0 = – 296. kJ.mol-1
V intersticiálních karbidech (TiC, ZrC, VC, NbC, TaC, V2C, MoC, Mo2C, WC, W2C) jsou atomy uhlíku umístěny v oktaedrických mezerách nejtěsnějšího uspořádání kationtů kovu (poloměr kovového iontu nesmí být menší než 135 pm). Vznikají zahříváním práškového kovu s uhlíkem na vysokou teplotu, zachovávají si kovové vlastnosti včetně vysokých bodů tání (3 000–4 000 °C za rozkladu) a některé jsou velmi tvrdé (karbidy tantalu a wolframu se používají při výrobě rychlořezných nástrojů).
Třetí skupinu tvoří karbidy chromu, manganu a triády železa (Cr3C2, Mn3 C, Fe3C, Co3C, Ni3C) představující přechod mezi iontovými a intersticiálními karbidy. Poloměry kovových atomů jsou v této skupině příliš malé pro vznik intersticiálních karbidů, struktura je silně deformována a prostoupena řetězci uhlíkových atomů. Vodou a zředěnými kyselinami se rozkládají za tvorby směsi uhlovodíků a vodíku.
Kovalentní karbidy (Be2C, B4C, Al4C3 , SiC; tvoří trojrozměrné mřížky) se připravují reakcemi prvků nebo jejich oxidů s uhlíkem. Karbidy beryllnatý Be2C a hlinitý Al4C3 se vodou rozkládají za tvorby methanu (methanidy), karbid křemičitý (karborundum) SiC a karbid tetraboru B4C s vysokými body tání jsou chemicky inertní a mimořádně tvrdé.
Suboxid uhlíku C3O2 (O=C=C=C=O) je bezbarvý páchnoucí plyn, tvořený lineárními molekulami. Připravuje se dehydratací kyseliny malonové CH2(COOH)2 oxidem fosforečným, a lze ho proto považovat za anhydrid této kyseliny. Jeho směs s kyslíkem je výbušná.
Sloučeninou téhož typu je anhydrid kyseliny mellitové C12O9 vznikající dehydratací kyseliny mellitové C6(COOH)6).
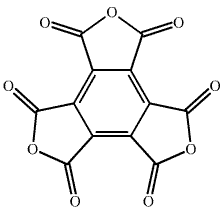
Oxid C12O9
Oxid uhelnatý CO (b. t. -204 °C , b. v. -191.5 °C) je bezbarvý, obtížně zkapalnitelný plyn bez zápachu, velmi málo rozpustný ve vodě. Vzniká hořením uhlíku při nedostatku kyslíku. Molekula |C≡O| s trojnou vazbou má velmi malý dipolový moment (0,1 D, polarita vazby téměř vyrovnává parciální náboje na atomech uhlíku a kyslíku).
Oxid uhelnatý je poměrně reaktivní, při 700 °C shoří na oxid uhličitý. Není pravým anhydridem žádné kyseliny, tavením s hydroxidy alkalických kovů poskytuje mravenčany. Za vyšších teplot redukuje oxidy železa, manganu a jiných kovů. Palladium redukuje už za laboratorní teploty z vodných roztoků jeho solí.
Oxid uhelnatý má schopnost vázat se jako ligand na ionty přechodných kovů za vzniku karbonylových komplexů (komplexy tvoří i s některými solemi – CuCl.CO.2H2O). Je jedním z nejnebezpečnějších jedů pro organismy, které mají v krvi hemoglobin (tvoří s hemoglobinem stabilnější komplex než dikyslík, a zamezuje tím dýchání organismu; 0,1 % obj. ve vzduchu je už životu nebezpečné).
Laboratorně se oxid uhelnatý připravuje působením koncentrované kyseliny sírové na kyseliny mravenčí
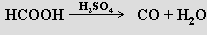
nebo šťavelovou
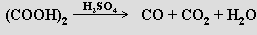
Je složkou dvou technických plynů. Generátorový plyn (25 % CO, 70 % N2, 4 % CO2) se vyrábí v šachtových pecích, v nichž se přes vrstvu koksu prohání vzduch. Rovnováha reakce

je vzhledem k jejímu endotermickému charakteru posunuta při 400 °C zcela vlevo, při 1 000 °C zcela vpravo a poměrné zastoupení oxidu uhelnatého a uhličitého ve výsledné plynné směsi je určeno pouze teplotou. Vodní (syntézní) plyn (40 % CO, 50 % H2, 5 % CO2, 5 % N2) vzniká při střídavém vhánění vzduchu a vodní páry do šachtové pece a používá se k výrobě organických sloučenin.
Oxid uhličitý CO2 je bezbarvý plyn slabě kyselého zápachu i chuti. Je obsažen v malém, přibližně konstantním množství (0,03 %) v atmosféře. Snadno se zkapalňuje (kritické veličiny jsou tk = 31 °C, pk = 6,96 MPa), při -78,5 °C sublimuje. Je rozpustný ve vodě (1,71 litru CO2 v 1 litru vody při 0 °C), varem ho lze zcela vypudit.
Ve všech skupenstvích tvoří lineární nepolární molekuly (rCO = 115 pm v plynné a rCO = 105 pm v pevné fázi).

Je nejstálejším oxidem uhlíku (stupeň jeho termické disociace při 1 200 °C je pouze 0,03 %), anhydridem kyseliny uhličité a slabým oxidačním činidlem, které redukují jen velmi silná redukovadla (vodík, uhlík, hořčík, sodík) při zvýšené teplotě na oxid uhelnatý nebo uhlík. Vyrábí se spalováním uhlíku při dostatečném přístupu vzduchu
C (s) + O2 (g) → CO2 (g)
nebo termickým rozkladem uhličitanů některých kovů
CaCO3 → CaO + CO2
Dusíku ho lze zbavit zaváděním do roztoku uhličitanu draselného a následným rozkladem vzniklého hydrogenuhličitanu varem. Laboratorně se získává rozkladem uhličitanu vápenatého kyselinami
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Obrázek 7.5. Příprava oxidu uhličitého vytěsněním z uhličitanu kyselinou
Příprava oxidu uhličitého vytěsněním z uhličitanu kyselinouPevný oxid uhličitý (suchý led) se používá k chlazení v potravinářství i v chemických laboratořích.
Sirouhlík CS2 (b. t. -111,6 °C, b. v. 46,2 °C) je bezbarvá kapalina s aromatickou vůní (žluté zbarvení a nepříjemný zápach obchodních preparátů způsobují nečistoty) a vysokým indexem lomu. Neomezeně se mísí s alkoholy, diethyletherem a benzenem, ale nikoliv s vodou. Strukturně je analogický oxidu uhličitému (rCS = 154 pm). Vodní parou se nad 150 °C rozkládá za tvorby oxidu uhličitého a sulfánu, na vzduchu hoří na oxid uhličitý a oxid siřičitý.
Připravuje se vedením par síry přes rozžhavené uhlí
2 S (g) + C (s) → CS2 (g); ΔH0 = 104,2 kJ.mol-1
Používá jako rozpouštědlo (dobře rozpouští síru, bílý fosfor, kaučuk a tuky) a extrakční činidlo.
Sulfid uhelnatý CS je už při -196 °C nestabilní. Sulfid karbonylu COS je bezbarvý plyn bez zápachu vznikající reakcí oxidu uhelnatého se sirnými parami. Strukturně je analogický oxidu uhličitému, ve vodě se poměrně dobře rozpouští za pozvolného rozkladu
COS + H2O → CO2 + H2S
Chemicky inertní fluorid uhličitý CF4 je třikrát těžší než vzduch a připravuje se působením fluoru na karbid křemičitý.
Chlorid uhličitý CCl4 je kapalina s nasládlým zápachem a karcinogenními účinky vznikající chlorací sirouhlíku
2 CS2 + 3 Cl2→ 2 CCl4 + S2Cl2
Používá se jako rozpouštědlo a podobně se uplatňují i částečně substituované halogenoderiváty uhlovodíků (chloroform CHCl3, dichlormethan CH2Cl2). Bromid uhličitý CBr4 je světle žlutá a jodid uhličitý CI4 tmavě červená pevná látka.
Obrázek 7.8. Bromid uhličitý vzniká reakcí aktivního uhlí a elementárního bromu
Bromid uhličitý vzniká reakcí aktivního uhlí a elementárního bromu..Tetrafluorethen C2F4, který se připravuje působením fluorovodíku na chloroform CHCl3, lze polymerovat na chemicky vysoce inertní (nachází proto použití v chemické syntéze při konstrukci aparatur pro práci s vysoce korozívními látkami) materiál teflon (C2F4)n vyznačující se velmi malou adhezí (užívá se proto k úpravě povrchu kuchyňských nádob sloužících k tepelnému zpracování potravin bez použití tuku) a koeficientem tření
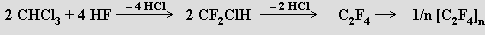
Z velkého množství halogenderivátů uhlovodíků jsou v posledních letech nejsledovanější fluorochloroderiváty nazývané freony. Směs jejich nejjednodušších zástupců lze připravit reakcí
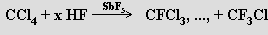
Nejsou jedovaté, nepůsobí korozívně a mají vysoká skupenská vypařovací tepla. Používaly se proto ve velkých množstvích jako náplň chladících strojů a hnací plyny ve sprejích. Poznání, že ničí ozónovou vrstvu atmosféry, vedlo k celosvětové snaze o omezení jejich produkce.
Kyselina uhličitá H2CO3 je v malém množství přítomna v roztoku oxidu uhličitého ve vodě v rovnováze s jeho volně hydratovanou formou CO2.xH2O
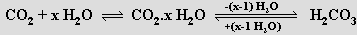
Z vodného roztoku ji nelze izolovat, při zahřívání i vymrazování se rozkládá (rozkladem uhličitanu sodného kyselinou chlorovodíkovou za nízké teploty v prostředí dimethyletheru lze izolovat krystalický etherát H2CO3.O(CH3)2). Stanovení podílu kyseliny a hydrátu je možné neutralizační titrací, protože rovnováha mezi nimi se obnovuje pomalu. Ionizuje jako středně silná kyselina s pK = 3,58, uvažuje-li se však celková koncentrace [H2CO3 + CO2.xH2O], dostaneme pro pK hodnotu 6,37 odpovídající slabé kyselině. Poskytuje dvě řady solí – uhličitany a hydrogenuhličitany.
Uhličitany tvoří většina kovů v oxidačních stupních +I a +II. Ve vodě jsou dobře rozpustné jen uhličitany alkalických kovů (s výjimkou Li2CO3), které se taví bez rozkladu (termická stabilita je podmíněna intenzitou polarizačního účinku kationtu), zatímco ostatní se rozkládají za vzniku oxidů
CaCO3→ CaO + CO2
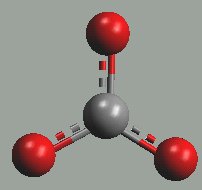
Uhličitanový anion má strukturu planárního trojúhelníku (rCO = 123 pm).
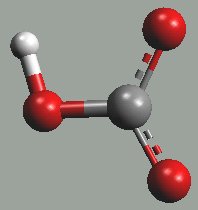
Anion hydrogenuhličitanový je slabou kyselinou (pK = 10,3) a je schopen existence ve spojení s kationty alkalických kovů, kovů alkalických zemin a některých dalších kovů v oxidačním stupni +II.
 |  |
Ve vodě jsou hydrogenuhličitany většinou dobře rozpustné, méně rozpustné jsou NaHCO3 a Ca(HCO3)2
Obrázek 7.9. Uhličitany kovů alkalických zemin způsobují tvrdost vody
Uhličitany kovů alkalických zemin způsobují tvrdost vodyRoztoky uhličitanů reagují v důsledku hydrolýzy silně zásaditě
CO32– + H2O ⇌ HCO3– + OH–
roztoky hydrogenuhličitanů slabě zásaditě
HCO3– + H2O ⇌ H2CO3 + OH–
Termickým rozkladem pevných hydrogenuhličitanů nebo zahříváním jejich roztoků se za uvolnění oxidu uhličitého a vody tvoří uhličitany
2 NaHCO3 → Na2CO3 + H2O + CO2
Uhličitany i hydrogenuhličitany se rozkládají působením kyselin (silnějších než je kyselina uhličitá) za tvorby solí těchto kyselin.
Peroxouhličitany MCO4 vznikají reakcí peroxidu vodíku s uhličitany alkalických kovů. Není dosud známo, zda jde o pravé soli kyseliny peroxouhličité nebo o peroxohydráty uhličitanů. Peroxodiuhličitany MI2C2O6 se tvoří elektrolýzou koncentrovaných roztoků alkalických uhličitanů při nízké teplotě. Atomy uhlíku jsou v nich spojeny můstkem -O-O-
Kyselina trithiouhličitá H2CS3 se uvolňuje působením kyseliny chlorovodíkové nebo sírové na trithiouhličitany jako nestálá olejovitá kapalina pomalu se rozkládající na sirouhlík a sulfán. Poměrně stálé trithiouhličitany alkalických kovů lze připravit reakcí sirouhlíku s příslušnými sulfidy.
Dichlorid karbonylu (fosgen) COCl2 je jedovatý, bezbarvý plyn dusivého zápachu, který se získává reakcí oxidu uhelnatého s chlorem.
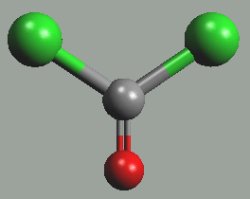
Ve vodě je málo rozpustný a pomalu s ní reaguje
COCl2 + 2 H2O → HCl + H2O + CO2
Používá se v organické syntéze (dříve i jako bojová chemická látka). Termickým rozkladem chloridu uhličitého v pří tomnosti kyslíku vzniká při hašení tetrachlorovými hasícími přístroji, a proto se pro tento účel chlorid uhličitý již nepoužívá.
Dichlorid thiokarbonylu CSCl2 (thiofosgen, b. v. 76 °C) je červená kapalina nepříjemného zápachu. Vzniká reakcí
CS2 + PCl5→ CSCl2 + PSCl3
a vodou se pomalu rozkládá na oxid uhličitý, sulfán a chlorovodík.
Diamid karbonylu (močovina) CO(NH2)2 se tvoří reakcí oxidu uhličitého s amoniakem, jako meziprodukt vzniká amonná sůl kyseliny amidouhličité NH4CO2NH2
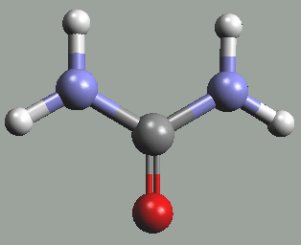 |  |
Kyanovodík HCN (b. t. -13,4 °C, b. v. 25,6 °C) je bezbarvá, snadno pohyblivá kapalina s charakteristickým zápachem po hořkých mandlích. Má permitivitu větší než voda (107 při 25 °C) a je proto výborným rozpouštědlem elektrolytů. Dobře se rozpouští ve vodě, roztok se chová jako velmi slabá kyselina (pKa = 9,14). Tvoří lineární molekuly H–C≡N| , bez přítomnosti stabilizátoru polymeruje (mj. na tetramer (H2N)(NC)C=C(CN)(NH2)).
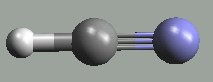
Je velmi prudkým jedem zapřičiňujícím ochrnutí dýchacího centra nervové soustavy. Připravuje se reakcí methanu s amoniakem (proces Degussa, ≈ 1 300 °C, platinový katalyzátor, výtěžek ≈ 90 %)
CH4 + NH3 → NCH + 3 H2
Většina se ho spotřebuje na výrobu methylmetakrylátu, acetonitrilu (CH3CN) a kyanidu sodného.
Kyanidy MCN se, stejně jako kyanatany, thiokyanatany a azidy, podobají v mnoha ohledech chloridům a označují se proto jako pseudohalogenidy. Alkalické kyanidy jsou ve vodě rozpustné, ostatní nikoliv (výjimkou je Hg(CN)2), v nadbytku kyanidových iontů ale často vznikají rozpustné kyanokomplexy. Anion CN− je velmi slabou zásadou a kyanidy jsou v roztoku silně hydrolyzovány (varem okyseleného roztoku z něj lze kyanovodík zcela vypudit). Technicky důležité soli sodná a draselná se nyní získávají neutralizací kyseliny kyanovodíkové příslušným hydroxidem. Dříve se kyanid sodný NaCN připravoval Castnerovým procesem

V komplexech může anion CN− vystupovat jako jedno- i dvojvazný ligand, donorem je vždy atom uhlíku. Vazby k centrálnímu kovovému kationtu bývají velmi pevné vzhledem k možnosti π-vazebné interakce. Za mírných oxidačních podmínek rozpouští roztok kyanidu sodného zlato za vzniku dikyanozlatnanu sodného, čehož se využívá k získávání tohoto kovu z jeho chudých rud.
8 NaCN + 4 Au + 2 H2O + O2 → 4 Na[Au(CN)2] + 4 NaOH
Dikyan (CN)2 (N≡C-C≡N, b. t. -27,9 °C, b. v. -21,2 °C) je bezbarvý jedovatý plyn s charakteristickým štiplavým zápachem, který se dobře rozpouští ve vodě, alkoholech i diethyletheru. Tvoří lineární molekuly s delokalizovaným systémem π-vazeb.
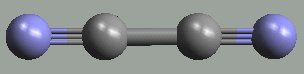
Termicky je vysoce stabilní (až nad 1000 °C disociuje na radikály ·CN), ne zcela čistý dikyan však termicky (400 až 500 °C) polymeruje na parakyan (CN)x. Účinkem alkalických hydroxidů přechází na kyanid a kyanatan
(CN)2 + 2 OH– → CN– + OCN– + H2O
Pro přípravu dikyanu je vhodná reakce měďnaté soli s kyanidem alkalického kovu, při níž se tvoří kyanid měďnatý, který se zvýšením teploty (60 °C) už ve vodném prostředí rozkládá
2 Cu2+ + 4 CN– → 2 Cu(CN)2→ (CN)2 + 2 CuCN
Kyselina isokyanatá HNCO (H-N=C=O, b. t. -86,8 °C, b. v. 23,5 °C) vzniká jako nestálý produkt deamonace močoviny, který rychle trimerizuje na cyklickou kyselinu kyanurovou (CNOH)3.
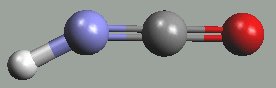 | 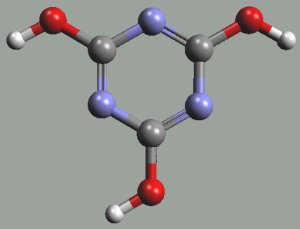 |
kyselina isokyanatá | kyselina kyanurová |
Je středně silnou kyselinou (pKa = 3,92), její soli lze připravit mírnou oxidací kyanidů
KCN + PbO → KNCO + Pb
Mimo iontových solí (M+NCO−) tvoří i kovalentní sloučeniny (Si(NCO)4).
Anion NCO− je lineární se strukturou analogickou oxidu uhličitému (často vystupuje jako ligand v komplexech).
Kyanatany se vodou hydrolyzují a rozkládají se na amonné soli a močovinu.
Kyseliny isokyanatá má dva strukturní izomery – kyselinu kyanatou H-O-C≡N (v čistém stavu ji nelze připravit, ≈ 3 % jsou v rovnováze s kyselinou isokyanatou při okyselení roztoku alkalických kyanatanů; její soli jsou totožné se solemi kyseliny isokyanaté) a kyselinu fulminovou H-C≡N-O (její soli jsou silně explozívní).
| Kyselina | Anion | |
|---|---|---|
| kyanatá | 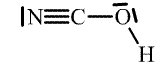 | 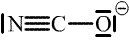 |
| isokyanatá | 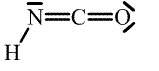 | |
| fulminová | 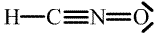 | 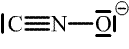 |
Za deriváty kyseliny kyanaté lze považévat halogenkyany XCN. Všechny jsou bezbarvé těkavé látky se slzotvornými účinky a sklonem k trimerizaci za vzniku cyklických halogenidů kyseliny kyanurové (XCN)3. Fluorkyan FCN byl připraven termickým rozkladem (FCN)3, chlorkyan ClCN a bromkyan BrCN vznikají reakcí roztoku alkalického kyanidu s příslušným halogenem. Jodkyan ICN se tvoří reakcí kyanidu rtuťnatého s jodem.
 |  |
NCN2 | Li2CN2 |
Kyselina thiokyanatá HNCS (b. t. -110 °C) vzniká působením KHSO4 na thiokyanatan draselný a je strukturně analogická kyselině isokyanaté. Je stálá jen při nízkých teplotách nebo ve zředěném roztoku, v němž se chová jako silná kyselina. Thiokyanatany se připravují tavením kyanidů se sírou. Ve vodě rozpustné jsou pouze thiokyanatany alkalických kovů a kovů alkalických zemin. Anion SCN− je lineární, často vystupuje jako ligand v komplexech. Může se vázat přes dusík i síru nebo jako můstkový ligand přes oba tyto atomy. S železitými kationty poskytuje thiokyanatanový anion intenzivně červený komplex používaný v kvalitativní analýze.
Je znám i bis(thiokyan) (SCN)2 vznikající jako bílá krystalická látka opatrnou oxidací AgSCN v diethyletheru nebo v kapalném oxidu siřičitém bromem nebo jodem. Při teplotě nad bodem tání (-7 °C) rychle polymeruje na cihlově červený parathiokyan (SCN)x. Existuje i obdobně se chovající žlutý bis(selenokyan) (SeCN)2 polymerací přecházející na červenou pevnou látku.