Helium je po vodíku nejrozšířenějším prvkem ve vesmíru (23 %), ale na Zemi je poměrně vzácné (je příliš lehké a gravitační pole Země ho není schopno udržet). Vzácné plyny jsou v malém množství (1 %; většina z toho je argon) složkou atmosféry, helium se nachází i ve zřídlech přírodních plynů (až 8 obj. %) a je okludováno v některých nerostech. V současnosti na Zemi existující helium, argon (vzniká přeměnou izotopu 40K) i radon 86Rn jsou výlučně produkty radioaktivního rozpadu.
Atomy vzácných plynů jsou vzájemně přitahovány jen slabými van der Waalsovými silami a mají velmi nízké body tání a varu. Lehčí z nich se svými vlastnosti blíží ideálním plynům. V přírodním heliu a argonu výrazně převládá jediný izotop (4He a 40Ar). Nejlehčí prvek 18. skupiny, helium, má řadu unikátních vlastností. Kapalné helium existuje ve dvou formách, z nichž první má při bodu varu (4,17 K) vlastnosti normální kapaliny, druhá při 2,18 K jeví supratekutost, jejíž příčiny nebyly dosud uspokojivě vysvětleny. Vlastnost je typická pro 4He a dává možnost jeho dělení od 3He. Plynné helium difunduje nejen pryží, ale i sklem.
Elektronové konfigurace atomů vzácných plynů jsou vysoce stabilní (ve valenční sféře elektronové oktety, helium dublet) a netvoří proto víceatomové molekuly. Mají vysoké ionizační energie, kationty jsou nestabilní, energeticky nejnižší neobsazené orbitaly (LUMO) jsou značně vzdáleny od orbitalů zaplněných elektrony (HOMO). Možnost tvorby koordinačních vazeb je tím výrazně potlačena. Nízká reaktivita jejich atomů byla podkladem pro formulaci oktetového pravidla v teorii kovalentní chemické vazby.
L. Pauling (1930) vyslovil předpoklad, že by mělo být možné připravit fluoridy xenonový a kryptonový, ale první pokusy o jejich experimentální přípravu nebyly úspěšné. Až do roku 1962 byly proto vzácné plyny považovány za neschopné tvorby sloučenin s výjimkou klathrátů. Teprve syntéza hexafluoroplatičnanu dioxygenylu O2+PtF6− reakcí dikyslíku (dikyslík a xenon mají přibližně stejné první ionizační potenciály) s fluoridem platinovým N. Bartlettem byla impulsem k úspěšnému pokusu o přípravu sloučenin těžších vzácných plynů. Již za laboratorní teploty poskytla reakce xenonu s fluoridem platinovým produkt formulovaný původně jako XePtF6. Pozdější studie ukázaly, že šlo o směs [XeF]+[PtF6]− s XeF+[Pt2F11]−
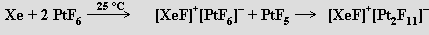
Analogickým postupem jako s fluoridem platinovým reaguje xenon také s reaktivními fluoridy rutheniovým, rhodiovým a plutoniovým, ale nikoliv se stabilními fluoridy uranovým nebo iridiovým.
Postupně pak byla připravena řada sloučenin těžších vzácných plynů, v nichž jsou vázány k nejelektronegativnějším prvkům (fluoru, kyslíku, chloru a dusíku) a jejichž strukturu dobře postihuje model VSEPR. Největší počet sloučenin tvoří xenon, několik jich je známo s kryptonem a radonem. Všechny tři prvky vystupují ve sloučeninách v sudých oxidačních stupních, xenon může dosáhnout až oxidačního stavu +VIII.
Neon, argon, krypton a xenon se získávají jako vedlejší produkt při frakční destilaci kapalného vzduchu. Získávání helia tímto způsobem není ekonomické (přestože je ho ve vzduchu 5× více než kryptonu) a jeho obvyklým zdrojem je zemní plyn.
Helium se používá jako chladící medium (ve vysokoteplotních jaderných reaktorech a při transportu kapalného kyslíku a vodíku jako raketových paliv), nosný plyn v plynové chromatografii, nehořlavá náplň meteorologických balónů a jako náhrada dusíku v dýchací směsi pro potápěče (ochrana před kesonovou nemocí). Neon, argon, krypton a xenon slouží jako náplň do výbojek, argon i jako ochranná atmosféra při svařování a práci s látkami citlivými na vzdušný kyslík. Radon se zřídka využívá jako α-zářič pro lékařské účely (τ1/2 = 3,825 dne).