Sloučeniny arsenu s vodíkem jsou bezbarvé, jedovaté, plynné látky podobné fosfanům.
Arsan AsH3 lze připravit rozkladem arsenidů neušlechtilých kovů vodou nebo zředěnými kyselinami
Na3As + 3 H2O → AsH3 + 3 NaOH
Použitelná je i redukce sloučenin arsenu v kladných oxidačních stupních vodíkem ve stavu zrodu
As2O3 + 6 Zn + 12 H3O+ → 2 AsH3 + 6 Zn2+ + 15 H2O
Při zahřívání se arsan snadno rozkládá na své složky, čehož se využívá při Marshově zkoušce sloužící ke kvalitativnímu zjištění přítomnosti sloučenin arsenu (redukce vzorku vodíkem ve stavu zrodu a následná tvorba arsenového zrcátka na stěně zahřívané skleněné trubice, jíž jsou plynné zplodiny vedeny). Na vzduchu hoří šedomodrým plamenem
4 AsH3 + 6 O2 → As4O6 + 6 H2O
Působí silně redukčně, z roztoku dusičnanu stříbrného vylučuje stříbro
AsH3 + 6 AgNO3 + 3 H2O → H3AsO3 + 6 Ag + 6 HNO3
Je současně velmi slabou kyselinou, takže arsenidy ve vodě zcela hydrolyzují. Arsoniové soli s kationtem AsH4+ nejsou známy pro zanedbatelnou bazicitu arsanu. Tepelně nestálý diarsan As2H4 (H2As–AsH2, b. v. 100 °C) se získá (spolu s AsH3) při redukci arsenitanů alkalickým tetrahydroboratem
2 H2AsO3– + BH4– + 3 H+ → As2H4 + H3BO3 + H2O + H2
Už při laboratorní teplotě se rozkládá na arsan a polymerní hydridy přibližného složení (As2H)n.
Stiban SbH3 a bismutan BiH3 mají analogické vlastnosti, existuje i distiban Sb2H4.
Oxid arsenitý As4O6 a antimonitý Sb4O6 vznikají hořením prvků na vzduchu nebo hydrolýzou trichloridů. Mají analogickou molekulovou stavbu jako P4O6, při vyšších teplotách přecházejí na As2O3 (nad 800 °C se v parách ustavuje rovnováha mezi oběma formami) resp. Sb2O3 (už před bodem tání při 600 °C). Těkavý oxid arsenitý se připravuje pražením arsenových rud na vzduchu
4 FeAsS + 10 O2 → As4O6 + 2 Fe2O3 + 4 SO2
Oxid antimonitý lze připravit reakcí
Sb4O5Cl2 + Na2CO3 → Sb4O6 + 2 NaCl + CO2
Oxid arsenitý se ve vodě rozpouští málo, oxid antimonitý nepatrně. Oba se rozpouštějí v silných kyselinách na soli arsenité resp. antimonité
Sb4O6 + 6 H2SO4 (konc.) → Sb2(SO4)3 + 6 H2O
a v hydroxidech alkalických kovů na arsenitany resp. antimonitany
As4O6 + 4 NaOH → 4 NaAsO2 + 2 H2O
Oxid bismutitý Bi2O3 lze připravit přímou syntézou z prvků nebo termickým rozkladem dusičnanu nebo oxid-uhličitanu bismutitého. Nemá již kyselé vlastnosti, dobře se rozpouští v roztocích silných kyselin za tvorby solí nebo oxidosolí. Alkalické hydroxidy srážejí z bismutitých solí nerozpustný hydroxid bismutitý, který při 100 °C přechází na oxid-hydroxid a při vyšších teplotách až na oxid bismutitý.
Oxid arseničný As2O5 se ve vodě rozpouští na kyselinu trihydrogenarseničnou H3AsO4, oxid antimoničný Sb2O5 je ve vodě málo rozpustný. Oba vznikají termickou dehydratací svých hydratovaných forem, které lze připravit oxidací prvků nebo oxidů M4O6 (M = As, Sb) kyselinou dusičnou
3 As + 5 HNO3 + 2 H2 O → 3 H3AsO4 + 5 NO
U antimonu je znám diamagnetický oxid antimonitoantimoničný Sb2O4 (minerál cervantit) obsahující antimon ve dvou oxidačních stupních (SbIII a SbV). Oxid bismutičný Bi2O5 (v čisté formě dosud nebyl připraven) je v kyselém prostředí extrémně silným oxidačním činidlem, ale současně nejhůře definovaným oxidem v této skupině.
Sulfid arsenitý As2S3 (b. t. 310 °C, b. v. 707 °C, minerál auripigment) je citronově žlutá krystalická látka v plynném skupenství tvořená molekulami As4S6 strukturně analogickými molekulám P4O6. Jsou známy i sulfidy o složení As4S3, As4S4 (2 izomery, minerál realgar) a As4S5. Nejlépe je z nich charakterizovaný červený sklovitý As4S4 (b. t. 320 °C, b. v. 565 °C), který na vzduchu hoří modrým plamenem za tvorby oxidu arsenitého. Strukturně je příbuzný tetranitridu tetrasíry S4N4. Sulfid antimonitý Sb2S3 je šedočerná krystalická nebo oranžová amorfní látka tvořená řetězovitými polymerními molekulami. Tvorba tmavohnědého sulfidu bismutitého Bi2S3 se využívá k důkazu i kvantitativnímu stanovení bismutu. Všechny uvedené sulfidy lze připravit přímou syntézou z prvků nebo srážením okyselených roztoků příslušných solí sulfánem
2 AsO2– + 3 H2S → As2S3 + 2 H2O + 2 OH–
V nadbytku sulfidů alkalických kovů se As2S3 i Sb2S3 rozpouštějí na thiosoli MI2YS3 (Y = As, Sb). Thiobismutitany MIBiS2 vznikají tavením příslušných sulfidů
Bi2S3 + Na2S → 2 NaBiS2
Sulfidy arseničný As2S5 a antimoničný Sb2S5 lze získat zaváděním sulfánu do vychlazeného roztoku arseničnanu resp. antimoničnanu alkalického kovu. Thioarseničnany M3AsS4 se tvoří působením polysulfidů alkalických kovů na sulfid arsenitý.
Trihalogenidy MX3 (M = As, Sb, Bi) mají trigonálně-pyramidální strukturu. Fluoridy MF3 se přípravují reakcí fluorovodíku s oxidy M2O3, ostatní lze získat přímou syntézou z prvků. Halogenidy bismutité BiX3, které nepodléhají tak snadno hydrolýze jako trihalogenidy obou lehčích prvků, lze získat i z vodných roztoků.
Chlorid arsenitý AsCl3 se připravuje působením chlorovodíku na oxid arsenitý
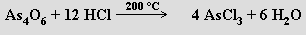
Snadno se hydrolyzuje, ale v nadbytku kyseliny chlorovodíkové se tvoří opět chlorid arsenitý (na rozdíl od PCl3 jde tedy o vratnou reakci)
AsCl3 + 3 H2O ⇌ H3AsO3 + 3 HCl
Chlorid antimonitý SbCl3 vzniká rozpouštěním Sb2S3 v horké kyselině chlorovodíkové
Sb2S3 + 6 HCl → 2 SbCl3 + 3 H2S
Hydrolyzuje se ve dvou stupních na nerozpustné oxid-chloridy
SbCl3 + H2O → SbOCl + 2 HCl
4 SbOCl + H2O → Sb4O5Cl2 + 2 HCl
Chlorid arsenitý a antimonitý mají význam jako nevodná rozpouštědla s téměř zanedbatelnou autoionizací. Oba jsou slabými donory elektronového páru, jejich akceptorické schopnosti jsou výraznější (tvoří halogenoanionty typu SbCl62−). S alkoholy poskytují estery kyseliny arsenité resp. antimonité, se sekundárními aminy vznikají dialkylaminoderiváty.
Fluorid bismutitý BiF3 (krystaluje ve struktuře fluoridu vápenatého) je ve vodě nerozpustný, ostatní trihalogenidy bismutité se vodou hydrolyzují za tvorby oxid-halogenidů BiOX (X = Cl, Br, I; jsou to vrstevnaté polymery s koordinačním číslem bismutu devět). Je známa řada komplexních halogenoaniontů bismutitých (Na[BiCl4], Na2[BiBr5]). Tvorba smíšených halogenidů je oproti chemii fosforu preferována podstatně méně.
Pentahalogenidy MX5 mají trigonálně-bipyramidální stavbu analogickou fluoridu fosforečnému. Pentafluoridy jsou popsány u všech tří prvků, pentachloridy jen u arsenu a antimonu. Všechny se připravují přímou syntézou v nadbytku halogenu. Jsou to silná oxidovadla, která se vodou snadno hydrolyzují. Chlorid arseničný AsCl5 se podařilo syntetizovat poměrně nedávno (1976) ozařováním chloridu arsenitého v kapalném chloru při -105 °C UV-zářením jako termicky málo stabilní látku (rozkládá se už při teplotách nad -50 °C). Chlorid antimoničný SbCl5 je podstatně termicky stabilnější. Nejreaktivnější látkou této skupiny je fluorid bismutičný BiF5, který s vodou reaguje explozivně (při reakci vzniká i ozon a difluorid kyslíku) a za mírných podmínek fluoruje řadu typů sloučenin.
Kyselina trihydrogenarsenitá (orthoarsenitá) H3AsO3 existuje pouze ve vodných roztocích a je velmi slabou kyselinou (srovnatelná s kyselinou trihydrogenboritou). V alkalickém prostředí postupně deprotonizuje na AsO(OH)2−, AsO2(OH)2− a AsO33−. Ve vodě jsou rozpustné pouze arsenitany alkalických kovů. Některé z nich mají složení meta-arsenitanů (metaarsenitan sodný NaAsO2), příkladem orthoarsenitanu může být žlutý, ve vodě málo rozpustný orthoarsenitan tristříbrný Ag3AsO3, jehož tvorba se využívá k důkazu arsenitanů. Kyselina metaantimonitá HSbO2 a její soli nejsou tak dobře definovány jako výše uvedené sloučeniny arsenité, jsou však známy některé metaantimonitany (NaSbO2) a polyantimonitany (Na2Sb4O7). Hydroxid bismutitý Bi(OH)3 se v kyselinách rozpouští za vzniku bismutitých solí (BiCl3), zvýšením pH dochází ke srážení oxidosolí (BiOCl).
Kyselina arseničná H3AsO4 poskytuje tři řady solí (MIH2AsO4, MI2HAsO4 a MI3AsO4), které se podobají fosforečnanům a jsou s nimi obvykle izomorfní. Tavením oxidu antimoničného s alkalickými hydroxidy vznikají hexahydroxoantimoničnany M[Sb(OH)6] (tvorba bílého nerozpustného hexahydroxoantimoničnanu sodného Na[Sb(OH)6] se využívá k důkazu přítomnosti kationtů Na+). Okyselením se z jejich roztoků vylučuje hydrát oxidu antimoničného Sb2O5.xH2O a sloučeniny MISbO3, MIIISbO4 a MII2Sb2O7 je proto vhodnější považovat za podvojné oxidy (jsou známy rutilové, ilmenitové i defektní spinelové struktury) a nikoliv antimoničnany. Bismutičnany MIBiO3 jsou v kyselých roztocích silnými oxidovadly (podobně jako oxid bismutitý). Vznikají tavením oxidu bismutitého s oxidy alkalických kovů v přítomnosti kyslíku.
Je známa řada organoprvkových sloučenin arsenu a antimonu typu MR3 (As(CH3)3, Sb(C2H5)3). Připravují se reakcemi chloridů arsenitého a antimonitého s dialkylsloučeninami zinku. Jde o jedovaté, nepříjemně páchnoucí kapaliny, které s alkylhalogenidy tvoří alkylarsoniové a alkylstiboniové soli. Tetramethylderivátem diarsanu As2(CH3)4 je mimořádně jedovatá a odporně páchnoucí sloučenina s triviálním názvem kakodyl. Hydroxid tetramethylarsonia [As(CH3)4]OH se podařilo připravit reakcí jodidu tetramethylarsonia s vlhkým oxidem stříbrným. Reakcí alkyldihalogenidů arsenitých se sodíkem v diethyletheru lze připravit cyklo-polyarsany (RAs)n (n = 3–6), které se, podobně jako substituované arsany, uplatňují jako ligandy. Z organoprvkových sloučenin AsV je známa úplná řada sloučenin obecného vzorce R5-nAsXn. Sb(C6H5)5 byl první sloučeninou prvku p-bloku s deseti valenčními elektrony, u níž byl zjištěn tetragonálně pyramidální tvar molekul. Popsán byl i nestálý Bi(C6H5)5. Všechny tři prvky tvoří řadu sloučenin, v nichž byly detekovány hetero- i homoatomické klastry. Vazby v některých takových sloučeninách bismutu mají elektronově deficitní charakter.