Uran byl objeven v jáchymovském smolinci (1789, M. H. Klaproth; izolace kovu B. Peligot, 1841), thorium (název dostalo podle severského boha války Thora) bylo připraveno redukcí chloridu thoričitého (získaného z thoritu ThSiO4 přes oxid thoričitý jako meziprodukt) draslíkem (J. J. Berzelius, 1828) a vzácné protaktinium (mateřský prvek aktinia) bylo identifikováno jako člen rozpadové řady 238U (1913, K. Fajans a O. Göhring). Impulsem pro přípravu těžších aktinoidů bylo zjištění, že pohlcení neutronu jádrem těžkého prvku bývá spojeno s emisí elektronu a zvýšením protonového čísla o jednotku. Ostřelováním 238U neutrony bylo připraveno 239Np (E. M. McMillan, P. H. Abelson, 1940) a v následujících letech i ostatní aktinoidy. Pro prvky následující v periodickém systému za uranem se používá skupinový název transurany. Neptunium a plutonium se podobají uranu do té míry, že jsou označovány skupinovým názvem uranoidy. Ze stejných důvodů jsou prvky 97 až 103 následujících za curiem nazývány curoidy.
Thorium (8,1 ppm) a uran (2,3 ppm) nepatří mezi příliš vzácné prvky, ale oba se vyskytují rozptýleně. Hlavním zdrojem thoria jsou monazitové písky (obsah oxidu thoričitého v nich bývá zpravidla menší než 10 %), uran se nachází jako smolinec U3O8 a karnotit K(UO2)VO4.3/2H2O, protaktinium v nepatrném množství doprovází uran.
Aktinoidy jsou stříbrolesklé elektropozitivní kovy tvořící většinou několik krystalografických modifikací (výjimkou je kalifornium; u plutonia bylo do bodu tání 639 °C identifikováno šest modifikací). Přírodní uran má dva izotopy s velmi dlouhými poločasy rozpadu – 238U (99,28 %, τ½ = 4,5.109 let) a 235 U (0,714 %, τ½ = 7.108 let), thorium pouze jeden – 232Th (τ½ = 1,4.1010 let; součástí uranové rozpadové řady jsou ještě 230Th s τ½ = 1,4.1010 let a 234U s τ½ = 2,5.105 let). Všechny tři jsou α-zářiči a výchozími prvky aktiniové, uranové a thoriové rozpadové řady. Radioaktivita uranu i thoria je tak nízká (přesto je pravděpodobně hlavním zdrojem tepla v zemském nitru), že experimentální práce s nimi i s jejich sloučeninami nečiní zvláštní obtíže.
Elektronové struktury aktinoidů nejsou úplnou analogií struktur lanthanoidů, protože energetické diference mezi orbitaly 4f a 5d resp. 5f a 6d nejsou totožné. S výjimkou protaktinia tvoří všechny aktinoidy kationty An3+. Mimo thoria, uranu, plutonia a nobelia je to současně nejstálejší oxidační stupeň a sloučeniny An3+ se nápadně podobají odpovídajícím sloučeninám lanthanoidů v témže oxidačním stavu. Oxidační stupeň +II je s výjimkou americia až nobelia málo stálý nebo vůbec neexistuje. U lanthanoidů výjimečný oxidační stupeň +IV se u aktinoidů vyskytuje běžně, pro thorium je to nejstálejší oxidační stupeň. Oxidační stav +VII byl prokázán pouze u neptunia a plutonia.
Aktinoidová kontrakce je méně výraznou obdobou kontrakce lanthanoidové. Ve sloučeninách často aktinoidy uplatňují vysoká koordinační čísla (sedm až čtrnáct). Sloučeniny, v nichž má aktinoid elektronovou konfiguraci radonu (AcIII, ThIV, PaV), jsou bezbarvé , ostatní jsou rozmanitě zbarvené.
Aktinoidy snadno reagují s vodou i vzdušným kyslíkem. Zahřátím s vodíkem poskytují hydridy AnH2 (An = Th, Np, Pu, Am, Cm) a AnH3 (An = Pa až Am). S mnoha kovy tvoří intermetalické sloučeniny a slitiny, s nekovy žáruvzdorné intersticiální boridy, silicidy, karbidy a nitridy s různorodou stechiometrií (vazby v karbidech a nitridech aktinoidů se strukturou chloridu sodného mají převážně iontový charakter s přebytečnými elektrony ve vodivostním pásu).
Všechny oxidy aktinoidů jsou žáruvzdorné materiály (oxid thoričitý má ze všech oxidů nejvyšší bod tání 3390 °C) s bazickými vlastnostmi a reaktivitou závislou na způsobu přípravy a zpracování. Dioxidy AnO2 s koordinačním číslem osm jsou známy u všech aktinoidů až po kalifornium. Termickým rozkladem dusičnanu uranylu UO2(NO3)2.6H2O vzniká oxid uranový UO3, jehož redukcí je možno dospět k řadě fází se složením mezi UO3 a UO2, mezi nimiž je i oxid uraničný U2O5 ( ten má ekvivalent i u protaktinia a neptunia). Amfoterní oxid uranový se v kyselinách rozpouští na soli uranylu UO22+ a v hydroxidech na uranany (diuranan disodný Na2U2O7.6H2 O se pod názvem uranová žluť používal jako barvivo). Počínaje plutoniem roste stabilita oxidů An2O3, které jsou strukturně analogické Ln2O3. S kationty alkalických kovů a kovů alkalických zemin tvoří aktinoidy směsné oxidy (MIAnVO3, MIIAnIVO3).
Hexafluoridy AnF6 (An = U, Np a Pu) jsou snadno těkavé pevné látky, jejichž stabilita vůči redukci klesá od uranu k plutoniu. Fluorid uranový UF6, který je jednou z mála těkavých sloučenin uranu (sublimuje při 56,5 °C), lze připravit z prvků nebo reakcí UF4 s kyslíkem
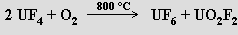
Využívá se k dělení 235U od 238U difúzí v plynné fázi při výrobě obohaceného jaderného paliva.
Pentahalogenidy AnX5 byly získány u protaktinia, uranu a neptunia (všechny čtyři u protaktinia, pouze fluorid u neptunia). Jsou buď dimerní se dvěma můstkovými atomy chloru (Cl4U(Cl2)UCl4, PaBr5) nebo lineární polymery s koordinačním číslem sedm (AnF5 a PaCl5).
Tetrafluoridy s tetragonální antiprizmatickou strukturou a koordinačním číslem osm jsou známy až po kalifornium. Tetrachloridy a tetrabromidy jsou známy až po neptunium, tetrajodidy jen po uran.
Nejkompletnější soubor tvoří trihalogenidy známé až po kalifornium a nepochybně je lze připravit i u těžších aktinoidů. Svými vlastnostmi (s výjimkou redoxních) se podobají trihalogenidům lanthanoidů (fluoridy jsou nerozpustné, ostatní halogenidy hygroskopické a ve vodě rozpustné, většinou tvoří hydráty).
Dihalogenidy AnII jsou známy pouze u americia (AmCl2, AmBr2 a AmI2) a kalifornia (CfBr2 a CfI2). U lehčích aktinoidů je známo několik dosud nedostatečně chrakterizovaných oxid-halogenidů.
V oxidačním stupni +VI se aktinoidy ve vodných roztocích vyskytují ve formě oxoaniontů aktinoylových AnO22+, jejichž stálost vůči redukci na AnV klesá od uranu k americiu
AnO22+ + e–→ AnO2+
Soli kationtů AnO22+ jsou termicky stabilní pevné látky, které jsou dobře rozpustné v roztocích fluoridů (toho lze využít k dělení aktinoidů od lanthanoidů, jejichž fluoridy jsou nerozpustné). V oxidačním stupni +V tvoří protaktinium až americium oxokationty AnO2+, jejichž stálost roste s protonovým číslem. Příčinou nestability je i v tomto případě disproporcionační reakce
2 AnVO2+ + 4 H3O+ → AnIV + AnVIO22+ + 6 H2O
V koncentrovaných roztocích fluoridů přechází kationty AnO2+ na fluorokomplexy AnF6− (An = Pa, U, Np, Pu), PaF72− a PaF83−, které jsou izostrukturní s analogickými sloučeninami niobičnými a tantaličnými. Sloučeniny aktinoidů v oxidačním stavu +IV ve vodoných roztocích disproporcionují (na AnIII a AnV nebo složitější směsi obsahující AnIII až AnVI). Hydroxidy, fluoridy, fosforečnany a šťavelany AnIV jsou ještě méně rozpustné než u AnIII.
Transurany se syntetizují ostřelováním jader uranu nebo lehčích transuranů nabitými částicemi (deuterony, α-částicemi), neutrony (233U, 235U a 239Pu produkují tepelné neutrony a podléhají řetězové reakci štěpení) nebo jádry lehčích prvků (bor, kyslík, dusík, uhlík, fluor). Kovy se obvykle připravují redukcí bezvodých fluoridů AnF3 nebo AnF4 alkalickými kovy nebo kovy alkalických zemin v inertní atmosféře a v reaktorech z málo reaktivních kovů (tantal) nebo kovových oxidů (beryllnatého, hořečnatého, thoričitého). Metalurgie uranu, neptunia a plutonia je prozkoumána lépe než u řady běžných kovů.