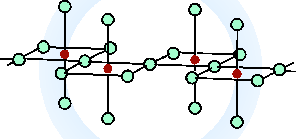
Oxid vanadičný V2O5 je oranžová krystalická látka s amfoterními vlastnostmi, která se připravuje z metavanadičnanu amonného NH4VO3 (produkt připravený spalováním kovu v nadbytku kyslíku je vždy kontaminován nižšími oxidy). Jeho struktura je složitá a sestává ze silně deformovaných trigonálních bipyramid VO5 spojených hranami do dvojitých lomených řetězců. Při zvýšené teplotě (700 až 1125 °C) se oxid vanadičný vratně rozkládá
2 V2O5 ⇌ 4 VO2 + O2
Toto chování je příčinou jeho katalytických schopností využívaných pro oxidaci oxidu siřičitého na oxid sírový při výrobě kyseliny sírové. Rozpuštěním oxidu vanadičného v kyselině sírové vzniká síran dioxovanadičný (VO2)2SO4, jehož redukcí lze připravit síran vanadylu(2+) VOSO4 jako pentahydrát i bezvodou sůl. Redukcí za zvýšené teploty lze z oxidu vanadičného připravit řadu (třináct) nižších oxidických fází.
Použije-li se k redukci oxidu vanadičného oxid uhelnatý nebo siřičitý, je produktem modročerný oxid vanadičitý VO2, redukce vodíkem poskytne šedočerný oxid vanaditý V2O3 až šedý oxid vanadnatý VO.
Vanad tvoří značný počet sulfidů, selenidů a telluridů, ale často s odlišnou stechiometrií (V3S, V5S4 , V7S8, V3S4) i strukturou než mají oxidy.
Jediným známým pentahalogenidem VV je fluorid vanadičný VF5 se strukturou řetězovitého polymeru, který lze připravit přímou reakcí prvků. Je silnou Lewisovou kyselinou schopnou tvořit adukty D.VF5 (D = donor), které lze redukovat na tetrahalogenidy MX4 (k přípravě VX4 je použitelná i reakce prvků za kontrolovaných podmínek).
Fluorid vanadičitý VF4 je světle zelená látka se sklonem k disproporcionaci
2 VF4 → VF3 + VF5
Červenohnědý kapalný chlorid vanadičitý VCl4 obsahuje tetraedrické molekuly a vodou se rychle hydrolyzuje na dichlorid vanadylu VOCl2. Na rozdíl od fluoridu vanadičitého se termicky místo disproporcionace rozkládá na chlorid vanaditý a chlor (stejně se chová i bromid vanadičitý VBr4)
2 VCl4 → 2 VCl3 + Cl2
Halogenidy vanadité jsou barevné krystalické polymery, v nichž má vanad koordinační číslo šest. Fluorid vanaditý VF3 je dostupný fluorací chloridu vanaditého suchým fluorovodíkem (s vodou poskytuje trihydrát, ostatní trihalogenidy tvoří hexahydráty) a z halogenidů vanaditých je nejstálejší vůči oxidaci vzdušným kyslíkem. Chlorid vanaditý VCl3 vzniká termickým rozkladem chloridu vanadičitého nebo zahříváním vanadu v proudu suchého chlorovodíku
2 V + 6 HCl → 2 VCl3 + 3 H2
Bromid vanaditý VBr3 a jodid vanaditý VI3 se tvoří reakcí prvků.
Všechny halogenidy vanadnaté VX2 jsou hygroskopické a mají silné redukční účinky. V jejich levandulově zbarvených vodných roztocích jsou přítomny nestálé kationty [V(H2O)6]2+. Chlorid vanadnatý VCl2 lze připravit disproporcionací chloridu vanaditého
2 VCl3 → VCl2 + VCl4
Oxid-halogenidy vanadu existují pouze v oxidačních stavech +IV a +V. Oxidací fluoridu vanaditého kyslíkem je dostupný trifluorid vanadylu VOF3
2 VF3 + O2 → 2 VOF3
Trichlorid vanadylu VOCl3 se tvoří reakcí chlorovodíku s oxidem vanadičným za přítomnosti oxidu fosforečného, který váže vznikající vodu
V2O5 + 6 HCl → 2 VOCl3 + 3 H2O
nebo zahříváním oxidu vanadičného s uhlíkem v proudu chloru
V2O5 + 3 C + 6 Cl2 → 2 VOCl3 + 3 COCl2
Dichlorid vanadylu VOCl2 vzniká jeho redukcí vodíkem
2 VOCl3 + H2 → 2 VOCl2 + 2 HCl
nebo hydrolýzou chloridu vanadičitého
VCl4 + H2O → VOCl2 + 2 HCl
V roztocích hydroxidů alkalických kovů (při pH > 13) se oxid vanadičný rozpouští na bezbarvé orthovanadičnany (krystalují jako hydráty Na3VO4.12H2O, K3VO4.6H2O), v nichž je vanad koordinován tetraedricky.
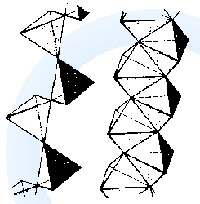
Při snižování hodnoty pH dochází ke kondenzačním reakcím za vzniku hydrogenvanadičnanů HVO42−, divanadičnanů V2O74−, hydrogendivanadičnanů HV2O73− (pH 9–13)
2 VO43– + 3 H3O+ ⇌ HV2O73– + 4 H2O
až metavadičnanů (VO3)nn− (pH 8–9). Při přechodu do kyselé oblasti se koordinační číslo vanadu zvýší na šest a převládajícími aniony se stanou dihydrogendekavanadičnany [H2V10O28]4− složené z kondenzovaných oktaedrů VO6

10 VO2+ + 22 H2O ⇌ [H2V10O28]4– + 14 H3O+
[H2V10O28]4– + H2O ⇌ [HV10O28]5– + H3O+
[HV10O28]5– + H2O ⇌ [V10O28]6– + H3O+
V isoelektrickém bodě (pH = 2,2) se z roztoku sráží hydratovaný oxid vanadičný, při dalším snižování pH se opět rozpouští za vzniku kationtů VO2+. Zbarvení polyvanadičnanů se prohlubuje se stupněm kondenzace (soli kationtu VO2+ jsou žluté, trivanadičnan amonný je zbarvený zlatě a pentavanadičnan draselný je tmavočervený).
S peroxidem vodíku poskytují vanadičnany intenzivně zbarvené peroxokomplexy. V alkalickém a netrálním prostředí vznikají žluté anionty dioxodiperoxovanadičnanové [VO2(O2)2]3− (známy jsou i modrofialové tetraperoxovanadičnany [V(O2)4]3−), v kyselých roztocích se tvoří červenohnědé kationty peroxovanadičné [V(O2)]3+.