Oxidy osmičelý OsO4 (b. t. 40 °C, b. v. 130 °C, nebezpečný pro zrak) a rutheničelý RuO4 (b. t. 25 °C, b. v. 40 °C, explozívní rozklad nad 108 °C) jsou lehce těkavé jedovaté krystalické látky s tetraedrickou strukturou. Oxid osmičelý se tvoří přímou reakcí prvků a rozpouští se lépe v organických rozpouštědlech než ve vodě (ve 100 g CCl4 se rozpustí 375 g OsO4, zatímco ve 100 g vody pouze 7 g). Oxid rutheničelý se připravuje oxidací vodných roztoků sloučenin ruthenia v nižších oxidačních stupních silnými oxidovadly (manganistany, chlorem, bromičnany nebo jodistany) a je silnějším oxidovadlem než oxid osmičelý (RuO4 oxiduje ethanol za výbuchu, zatímco OsO4 se v něm rozpouští a jen pomalu se redukuje na OsO2). Rozpuštěním oxidu osmičelého v roztoku alkalického hydroxidu vznikají oktaedrické osmičelany MI2H2OsVIII O6, které se snadno redukují na geometricky analogické osmiany MI2H4OsVIO6. Oxid rutheničelý se rozpouští za chladu ve zředěném roztoku hydroxidu draselného za tvorby nestabilního ruthenistanu draselného KRuVIIO4, který se snadno redukuje na ruthenan draselný K2RuVIO4 (lze ho získat i tavením kovového ruthenia s hydroxidem a dusičnanem draselným).
Oxid rutheničitý RuO2 vzniká přímou reakcí prvků, oxid osmičitý OsO2 se za zvýšené teploty tvoří redukcí oxidu osmičelého osmiem. Zahříváním ruthenia nebo osmia s oxidy (nebo uhličitany) alkalických kovů vznikají podvojné oxidy (Na5OsVIII O6, Li6OsVIO6, MII RuIVO3) s ionty přechodného kovu v oktaedrických mezerách oxidové mřížky. Se sírou tvoří oba prvky pouze diamagnetické disulfidy MIIS2 se strukturou pyritu.
Tvorba oxidů je u rhodia a iridia méně typická než u ruthenia a osmia. Zahříváním kovů v kyslíkové atmosféře vznikají šedý oxid rhoditý Rh2O3 (se strukturou korundu) a černý oxid iridičitý IrO2 (se strukturou rutilu). Jsou přístupné i dehydratací hydratovaných forem (Rh2O3.5H2O, IrO2.xH2O), oxid rhoditý i termickým rozkladem dusičnanu rhoditého.
Černý bezvodý oxid rhodičitý RhO2 (se strukturou rutilu) je produktem oxidace oxidu rhoditého při zvýšeném tlaku kyslíku, jeho dihydrát RhO2.2H2O se tvoří působením alkalických hydroxidů na roztoky vzniklé elektrolytickou oxidací rhoditých solí. Oxid iriditý Ir2O3, který vzniká tavením K2IrCl6 se sodou, se velmi snadno oxiduje na IrO2 a v čistém stavu se ho dosud nepodařilo připravit. U obou prvků jsou známy sulfidy se stechiometrií MS2 (tvoří se reakcí prvků) a M2S3 (sráží se sulfánem z roztoků solí MIII), které vynikají odolností vůči kyselinám.
Palladium a platina tvoří pouze po jednom dobře definovaném oxidu. Černý oxid palladnatý PdO vzniká zahříváním palladia v proudu kyslíku, při teplotách nad 900 °C opět disociuje na své komponenty. Z roztoků palladnatých solí se alkalickými hydroxidy sráží gel hydratovaného oxidu palladnatého, který nelze termicky úplně dehydratovat, protože se současně s vodou částečně odštěpuje i kyslík.
Oxid platičitý PtO2 lze získat dehydratací (také není nikdy zcela kvantitativní) jeho hydratované formy vznikající varem roztoku chloridu platičitého s uhličitanem sodným. Termická disociace oxidu platičité ho na prvky nastává již při teplotě ≈ 650 °C.
Palladium i platina tvoří sulfidy o složení MS a MS2. Sulfid palladnatý PdS (hnědý) a sulfid platičitý PtS2 (černý) se sráží sulfánem z vodných roztoků palladnatých resp. platičitých solí. Sulfid palladičitý PdS2 (šedý) a sulfid platnatý PtS (zelený; krystalický se nerozpouští ani v lučavce královské) se připravují na suché cestě (sulfid palladičitý reakcí sulfidu palladnatého se sírou a sulfid platnatý zahříváním směsi chloridu platnatého, uhličitanu sodného a síry).
Osmium i ruthenium tvoří binární sloučeniny se všemi halogenidy. Jsou známy fluoridy RuIII až RuVI a OsIV až OsVII (donedávna jako OsF8 popisovaná látka se ukázala být nejméně stálým fluoridem platinových kovů se stechiometrii OsF6), chloridy RuII, RuIII, OsIII až OsV, bromidy RuII, RuIII, OsIII a OsIV a jodidy RuII, RuIII, OsI až OsIII. Nejvyšším halogenidem osmia je fluorid osmistý OsF7 vznikající z prvků za extrémních teplotních i tlakových podmínek (600 °C, 40,5 MPa). Za mírnějších podmínek se tvoří hexafluoridy MF6 (M = Ru, Os), které prudce reagují s vodou a mají sklon k samovolnému rozkladu na fluor a nižší fluoridy. V tomto oxidačním stavu jsou známy také oxid-halogenidy (RuOF4) a oxohalogenoanionty. Dobře prozkoumány jsou soli [MO2X4]2− (M = Os, Ru), které u osmia vznikají reakcí
OsO4 + 3 HCl + 2 KCl → K2[OsO2Cl4] + Cl2 + 2 H2O
Pentafluoridy jsou cyklickými tetramery [MF5]4 a polymerní povahu mají i tetrafluoridy.
Halogenidy v oxidačních stavech +II a +III nepatří s výjimkou chloridu ruthenitého RuCl3 (výchozí látka pro syntézu jiných sloučenin ruthenia) k dobře charakterizovaným látkám. Bezvodý chlorid ruthenitý je znám ve dvou krystalových modifikacích. Ve vodného roztoku získaném rozpuštěním oxidu rutheničelého v kyselině chlorovodíkové jsou obsaženy kationty hexaaquaruthenité [Ru(H2O)6]3+, které snadno podléhají hydrolýze i oxidaci na RuIV. Po zahuštění roztoku v proudu chlorovodíku vykrystaluje chlorid ruthenitý jako trihydrát RuCl3.3H2O.
Rhodium a iridium v oxidačních stavech +IV až +VI tvoří pouze fluoridy. Hexafluoridy MF6 (M = Rh, Ir) jsou pevné, těkavé, mimořádně reaktivní látky s oktaedrickou koordinací kovu, které se připravují přímou reakcí prvků. Jejich opatrným termickým rozkladem je možno získat pentafluoridy (červený (RhF5)4, žlutý (IrF5)4) s tetramerní strukturou analogickou odpovídajícím sloučeninám ruthenia a osmia.
Fluorid rhodičitý RhF4 byl připraven působením fluoridu chloritého na bromid rhoditý a fluorid iridičitý IrF4 (má prostorovou polymerní strukturu příbuznou rutilu a při teplotě nad 400 °C disproporcionuje na IrF3 a IrF5) redukcí fluoridu iridičného stechiometrickým množstvím iridiové černi. Možnost existence tetrahalogenidů IrX4 (X = Cl, Br, I) (stejně jako halogenidů s oxidačním stupněm kovu menším než tři) je nejistá, soli s anionty hexahalogenoiridičitanovými [IrIVX6]2− (X = F, Cl, Br) však patří k dobře definovaným látkám.
Kompletní řady halogenidů obou prvků jsou známy v oxidačním stavu +III. Fluorid RhF3, chlorid RhCl3 a bromid rhoditý RhBr3 se připravují reakcí prvků, jodid rhoditý RhI3 vzniká srážením vodného roztoku bromidu rhoditého jodidem alkalického kovu. Bezvodé soli jsou nepříliš reaktivní, ve vodě nerozpustné látky. Z roztoků obsahujících kationty hexaaquarhodité [Rh(H2O)6]3+ je možno připravit trihydráty RhX3.3H2O (X = F, Cl, Br). Trihydrát chloridu rhoditého RhCl3.3H2O je obvyklou výchozí látkou pro přípravu dalších sloučenin rhodia a používá se i jako katalyzátor v organické syntéze. Fluorid iriditý IrF3 se připravuje redukcí fluoridu iridiového kovovým iridiem, chlorid IrCl3 a bromid iriditý IrBr3 přímou reakcí prvků za zvýšené teploty a jodid iriditý IrI3 termickou dehydratací jeho hydrátu ve vakuu. Hydráty chloridu, bromidu i jodidu iriditého lze získat rozpuštěním Ir2O3.xH2O v příslušné halogenovodíkové kyselině a následnou krystalizací.
Platina v oxidačních stavech +V a +VI tvoří pouze velmi reaktivní fluoridy, které se připravují přímou syntézou z prvků za kontrolovaných podmínek. Fluorid platinový PtF6 je jedním z nejsilně jších oxidačních činidel, nestálý tetramerní fluorid platičný (PtF5)4 snadno disproporcionuje na fluoridy platinový a platičitý.
V oxidačním stavu +IV vedle fluoridu palladičitého PdF4 (nejvyšší halogenid tohoto prvku) existuje kompletní řada halogenidů platičitých PtX4. Fluoridy MF4 (M = Pd, Pt) vznikají působením fluoridu bromitého na příslušné dichloridy MCl2, ostatní halogenidy platičité PtX4se připravují z prvků. Chlorid platičitý PtCl4 lze krystalovat z vody, v kyselině chlorovodíkové se rozpouští za vzniku kyseliny hexachloroplatičité H2PtCl6 (její amonná a draselná sůl jsou málo rozpustné). Bromid PtBr4 a jodid platičitý PtI4 se lépe rozpouštějí v organických rozpouštědlech (ethanol, diethylether) než ve vodě.
Trihalogenidy MX3 (M = Pd, Pt) známy nejsou, sloučeniny o složení PdF3 a PtX3 (X = Cl, Br, I) obsahují vždy MII a MIV v ekvimolárním zastoupení.
Z dihalogenidů není schopen existence fluorid platnatý PtF2 (zřejmě v důsledku neschopnosti platiny udržet v přítomnosti fluoru tak nízký oxidační stav). Snadno se hydrolyzující fluorid palladnatý PdF2 (fialový) je jednou z mála paramagnetických sloučenin palladnatých (konfigurace t62ge2g v oktaedrické koordinaci). Dichloridy MCl2 (M = Pd, Pt; jsou známy ve dvou izomerních formách) se připravují reakcí prvků. Chlorid palladnatý PdCl2 krystaluje z roztoku (z něhož lze palladium snadno vyredukovat oxidem uhelnatým nebo vodíkem) jako dihydrát. Chlorid platnatý PtCl2 se rozpouští v kyselině chlorovodíkové (ve vodě nikoliv) za tvorby aniontů tetrachloroplatnatanových [PtCl4]2−. Bromid PtBr2 a jodid platnatý PtI2 se připravují termickým rozkladem pří slušných tetrahalogenidů, jsou nestálé a jejich příprava v čistém stavu je obtížná. Bromid palladnatý PdBr2 vzniká přímou reakcí prvků, jodid palladnatý PdI2 se tvoří srážením vodného roztoku PtCl2 roztokem jodidu alkalického kovu. Při nadbytku halogenidu mohou vznikat anionty tetrahalogenopalladnatanové [PdX4]2− (X = Br, I). Z oxid-halogenidů je znám jen oxid-trifluorid platičný PtOF3.
Z komplexů RuVIII je známo pouze několik nestabilních aduktů oxidu rutheničelého s amoniakem. Nejstálejším komplexem OsVIII je aniont trioxonitridoosmičelanový [OsVIIIO3N]− s deformovanou tetraedrickou koordinací (obdobným aniontem je [ReVIIO3N]2−), který obsahuje trojnou vazbu Os≡N (absorpční pás valenční vibrace νOsN v infračerveném spektru má vlnočet 1023 cm-1). Jeho alkalické soli je možno připravit působením amoniaku na roztok oxidu osmičelého obsahující alkalický hydroxid (trioxonitridoosmičelan draselný K[OsO3N] byl připraven již v roce 1847, jeho stechiometrie byla určena až po více než 50 letech). Ty se působením kyseliny chlorovodíkové (nebo bromovodíkové) redukují na pentahalogenonitridoosmany MI2[OsVIX5N] je trojná vazba Os≡N zachována. Halogen v poloze trans- vůči dusíku je vázán výrazně slabší vazbou než zbývající čtyři, což usnadňuje přechod k tetragonálně pyramidálním aniontům tetrahalogenonitridoosmanovým [OsVIX4N]−.
Oba prvky tvoří v oxidačním stavu +VI značný počet oktaedrických aniontů (ruthenium méně) o složení [MVIL4O2]2− (L = halogen, OH, CN), v nichž jsou oba kyslíkové atomy v trans-poloze. V oxidačním stavu +V (i +VII) se tvorba komplexů omezuje na fluoroanionty ([MVF6]−). Ty jsou běžné i v oxidačním stavu +IV (pro osmium je to nejstabilnější stav v komplexech), v němž jsou známy anionty i s ostatními halogenidy (s výjimkou [RuIVI6]2−), některými oxoanionty ([Os(SO3)6]8−) a také organickými ligandy ([Os(bipy)2Cl4]).
Velmi stabilní jsou oktaedrické nízkospinové komplexy ruthenité, zatímco u osmia je tento oxidační stav (v důsledku snadné oxidace na OsIV) málo obvyklý. Kation hexaaquaruthenitý [Ru(H2O)6]3+ nebyl dosud v žádné sloučenině v pevném stavu izolován, v roztocích však byla prokázána existence kompletní řady aquachlorokomplexů ruthenitých [Ru(H2O)nCl6-n](n-3) (n = 0–6).
Reakcí chloridu ruthenitého s vodným roztokem amoniaku za přítomnosti kyslíku vzniká intenzivně červený roztok obsahující trojjaderný kationt [(NH3)5RuIII-O-RuIV(NH3)4-O-RuIII(NH3)5]6+ (rutheniová červeň), který slouží k citlivému důkazu i slabých (FeCl3) oxidačních činidel (barva se mění na žlutou, náboj se zvýší o jednotku beze změny složení a změna je pozorovatelná i při koncentraci ruthenia nižší než 1 ppm). Jsou známy i fluoro- (K3[RuF6]) a bromokomplexy ruthenité. Méně rozsáhlá než u FeII je chemie komplexů RuII ve vodných roztocích ([Ru(H2 O)6]2+v roztoku vzniká katodickou redukcí chloridu ruthenitého) a u OsII je minimální ([Os(H2O)6]2+ není znám, [Os(NH3)6]2+ je nestálý).
Nejstabilnější komplexy ruthenaté obsahují ligandy s dusíkovými donory ([Ru(NH3)5(NO)]3+, [Ru(CN)5(NO)]2−), odpovídající sloučeniny osmia jsou labilnější, protože, na rozdíl od RuII, potřebuje OsII ke své stabilizaci π-akceptorové ligandy (CN−, deriváty fosfanu). Kation [Ru(NH3)6]2+ má silné redukční vlastnosti a potenciálně jsou jeho deriváty se substituovanými bipyridylovými ligandy využitelné jako fotokatalyzátory pro rozklad vody na prvky. Kation [Ru(NH3)5 (N2)]2+ byl prvním připraveným komplexem didusíku (1965; tvoří se redukcí vodného roztoku chloridu ruthenitého hydrazinem), připraven byl i jeho méně stabilní ([Os(NH3)5(N2)]2+).
Komplexy rhodia a iridia v oxidačních stavech vyšších než čtyři jsou vzácné, nejznámější jsou soli aniontu hexafluoroiridičnanového [IrVF6]−. Komplexy rhodičité se omezují na snadno se hydrolyzující soli aniontů hexahalogenorhodičitanových [RhX6]2− (X = F, Cl), analogické anionty hexahalogenoiridičitanové jsou stálejší (znám je i anion hexabromoiridičitanový).
Většinou oktaedrické komplexy rhodité a iridité jsou bez vyjímek diamagnetické (s elektronovou konfigurací t62g). Rhodité komplexy (žluté, červené) se připravují z RhCl3.3H2 O, iridité z (NH4)3 [IrCl6].
Analogickým komplexům kobaltitým se podobají kineticky inertní amminkomplexy [MIII(NH3)6]3+ (M = Rh, Ir). Mimo [RhI6]3− a [IrF6]3− jsou známy všechny ostatní hexahalogenoanionty [MIIIX6]3− (X = halogen). Kation hexaaquarhoditý [RhIII(H2O)6]3+, existující v roztoku i v pevných krystalohydrátech, je stálejší než kation hexaaquairiditý [IrIII(H2 O)6]3+, který byl prokázán v roztocích iriditých solí v koncentrované kyselině chloristé. Redukce těchto sloučenin nevede ke komplexům rhodnatým resp. iridnatým (ty jsou u obou prvků vzácné), ale až k rhodným resp. iridným nebo se tvoří hydridokomplexy ([RhIIICl2HL3]). V obou případech je ke stabilizaci nutná přítomnost π-akceptorových ligandů (alkyl- nebo arylfosfany, výjimkou je [Rh(NH3]5H]2+).
Z komplexů rhodných a iridných jsou nejzajímavější sloučeniny typu [RhCl(P(C6H5)3)2] (Wilkinsonův katalyzátor umožňující rychlou hydrogenaci organických nenasycených sloučenin v homogenní fázi za laboratorní teploty) a [IrCl(CO)(P(C6H5)3)2] (Vaskův komplex). Roztok Vaskova komplexu má schopnost pohlcovat dikyslík a za vhodných podmí nek (probubláváním roztoku dusíkem) ho opět uvolňovat. Chová se tedy jako vratný přenašeč kyslíku a z toho hlediska byl jako modelová sloučenina podrobně studován.
Rhodium i iridium tvoří řadu komplexů i v nízkých oxidačních stavech 0 až -III ([Ir-III(bipy)3]3−).
V oxidačních stavech +V a +VI je známo jen několik komplexů platiny s fluorem a kyslíkem jako ligandy ([PtF6]−, PtOF3). Všechny známé komplexy MIV (M = Pd, Pt) jsou oktaedrické a diamagnetické (konfigurace t62g). Nepříliš stabilní komplexy palladičité reprezentují především anionty [PdX6]2− (X = F, Cl, Br). Nejběžnější z nich je anion hexachloropalladičitanový [PdCl6]2− (vzniká při rozpouštění palladia v lučavce královské). Nejméně stálý je anion hexafluoropalladičitanový [PdF6]2− (ve vodě se rozkládá na PdO.xH2O, zatímco zbývající dva halogenoanionty palladičitanové hydrolýzou poskytují [PdX4]2− a volný halogen X2 (X = Cl, Br)).
Kineticky inertní a termodynamicky stabilní komplexy platičité (byly využity A. Wernerem k modelovému studiu povahy vazby kov–ligand i molekulární geometrie komplexů) tvoří plynulou řadu od [PtX6]2− (není znám [Pt(CN)6]2−) přes [PtX4L2] až po [PtL6]4+ (X = halogen, CN−, SCN−; L = NH3, aminy). Kyselina hexachloroplatičitá H2[PtCl6].xH2 O se připravuje rozpouštěním platinové houby v lučavce královské a následným několikanásobným odpařením produktu s kyselinou chlorovodíkovou. Málo rozpustný hexachloroplatičitan draselný K2 [PtCl6] poskytuje redukcí hydrazinem tetrachloroplatnatan draselný K2[PtIICl4], který slouží jako výchozí materiál pro přípravu dalších komplexů platnatých.
V oxidačním stavu +III nebyly dosud palladium ani platina v komplexech identifikovány. Sloučeniny, jejichž stechiometrie tuto možnost připouští, vždy obsahují kov ve dvou oxidačních stupních (Pt(EtNH2)4Cl3.2H2O je řetězový polymer s chloridovými můstky mezi PtII a PtIV, který lépe popisuje vzorec ([PtII(EtNH2)4]2+[PtIVCl2(EtNH2)4]2+(Cl−)4.4H2O).
Komplexy palladnaté a platnaté představují nejrozsáhlejší a nejvýznamnější oblast komplexní chemie obou prvků. Všechny jsou diamagnetické a téměř výhradně čtvercově planární, jako ligandy jsou upřednostňovány anionty halogenidové (mimo fluoridů), kyanidy a donory s těžšími atomy. Komplexy s kyslíkatými donory jsou zastoupeny méně ([Pd(H2O)4]2+ v Pd(ClO4)2.4H2O, oligomerní acetáty [M(O2CMe)2]n s n = 3 pro palladium a n = 4 pro platinu). Anionty [MX4]2− (M = Pd, Pt) lze získat ve formě solí alkalických kovů. Použijí-li se pro jejich izolaci objemnější kationty (NR4+), vznikají dvojjaderné komplexy [M2X6]2− (X = Br, I), v nichž jsou kovové kationty spojené halogenidovými můstky. Ligandy v aniontech [MCl4]2− (M = Pd, Pt) snadno podléhají substituci, a slouží proto běžně jako výchozí materiál k přípravě jiných komplexů palladnatých a platnatých.
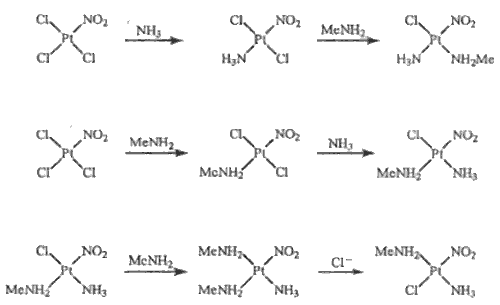
K nejdéle známým komplexům obou kovů patří [ML2 X2] a kationty [ML4]2+ (X = halogen; L = NH3, aminy). Prvním připraveným komplexem platiny (1828) byl monohydrát chloridu tetraamminplatnatého [Pt(NH3)4]Cl2.H2O, který získal G. Magnus působením amoniaku na vodný roztok chloridu platnatého. Tetrachloroplatnatan tetraamminplatnatý [Pt(NH3)4] [PtCl4] (Magnusova sůl) je sůl s komplexním kationtem i aniontem, která je polymeračním izomerem elektroneutrálního komplexu diammindichloroplatnatého [Pt(NH3)2Cl2] známého ve formě cis- a trans-izomeru. Tyto komplexy snadno podléhají substitučním reakcím, jejichž mechanismus byl podrobně studován. Nahrazením dvou chloridových aniontů v [PtCl4]2− dvěma molekulami amoniaku vzniká cis-dichlorodiamminplatnatý komplex
[PtCl4]2– + 2 NH3 → cis-[PtCl2(NH3)2] + 2 Cl–
zatímco náhradou dvou molekul amoniaku v kationtu tetraamminplatnatém dvěma anionty chloridovými vzniká jeho trans-izomer
[Pt(NH3)4]2+ + 2 Cl– → trans-[PtCl2(NH3)2] + 2 NH3
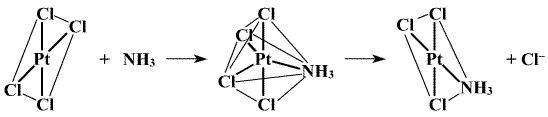
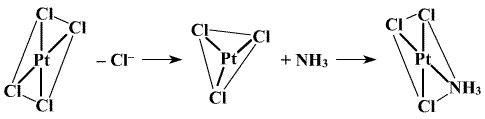
Vysvětlení tohoto jevu podala představa o trans-efektu (I. Čerňajev), podle níž se nejvýrazněji ovlivňují ligandy ležící vzájemně v trans-poloze. V prvním případě po substituci prvního ligandu Cl− je druhá molekula amoniaku směrována do cis-polohy, protože amoniak má slabší schopnost orientovat vstupující ligand to trans-polohy vůči sobě než anion Cl−. Ve druhém případě je ze stejných důvodů preferován vznik trans-izomeru. Podle schopnosti upřednostňovat substituci do trans-polohy vůči sobě lze běžné ligandy sestavit do řady C2H4 > NO2− > I− > Br− > Cl− > F− > NH3 > H2O. Představa je platná především pro platnaté a platičité komplexy. K jejímu rozšíření na jiné případy, v nichž lze rozlišit cis- a trans-polohu ligandů, je zatím nedostatek experimentálních podkladů. Na základě představy o trans-efektu a s uvážením rozdílné pevnosti vazeb různých ligandů se podařilo úspěšně připravit tři možné prostorové izomery komplexu [Pt(NH3)Cl(NH2Me)(NO2)]
Substituce probíhají mechanismem SN2 (mechanismus SN1 je pro komplexy platiny atypický), přičemž první pomalý krok představuje tvorbu trigonálně-bipyramidálního meziproduktu, který se rychle rozpadá (důkaz jeho tvorby je proto obtížný) za vzniku substituovaného produktu a původně v komplexu přítomného ligandu.
Některé komplexy platnaté (cis-[Pt(NH3)2Cl2], [PtCl2en], cis-[PtCl2(dach)]; dach = 1,2-diaminocyklohexan) se využívají jako protinádorová léčiva (účinné jsou jen cis-izomery).
V oxidačním stavu +II tvoří platina početné hydridokomplexy ([PtHX(PR3)2]), na vzduchu stálé látky rozpustné v organických rozpouštědlech. Oxidační stav nula mohou u obou prvků stabilizovat pouze fosfanové a arsanové ligandy. Komplexy [M0(PR3)4] (M = Pd, Pt) jsou pevné, žluté, na vzduchu stálé látky s tetraedrickou strukturou, které se připravují redukcí komplexů MII hydrazinem nebo tetrahydroboraty. V roztoku snadno přecházejí na trigonálně planární komplexy [M0(PR3)3].
U platinových kovů nejsou známy jednoduché alkyl- a arylderiváty se σ-vazbami M–C, jejichž stabilizace vyžaduje přítomnost π-akceptorových ligandů. Podobně jako u železa jsou i u těchto prvků z organokovových sloučenin nejvýznamnější karbonyly a metaloceny. Pentakarbonyl ruthenia [Ru(CO)5] lze snadno připravit působením oxidu uhelnatého na jemně dispergovaný kov, zatímco pentakarbonyl osmia [Os(CO)5] se nejvýhodněji získá redukční karbonylací oxidu osmičelého
OsO4 + 9 CO → Os(CO)5 + 4 CO2
V obou případech se pracuje za zvýšené teploty a tlaku a produkty jsou snadno těkavé kapaliny.
Rhodium a iridium vzhledem ke své elektronové konfiguraci tvoří binární karbonyly s charakterem klastrů ([M2(CO)8], [M4(CO)12], [M6(CO)16]; (M = Rh, Ir)). Připravují se zahříváním rhodia resp. směsi chloridu iriditého a mědi s oxidem uhelnatým za tlaku 20 až 30 MPa. Palladium a platina binární karbonyly netvoří.
Metalloceny ruthenia, osmia, rhodia a iridia mají složení i strukturu analogickou ferrocenu, u palladia a platiny jsou známy pouze komplexy s jedním cyklopentadienylovým kruhem.
Platina tvoří tetramerní sloučeniny [PtIVXMe3]4, v nichž jsou čtyři atomy platiny umístěné v rozích krychle spojeny trojitými halogenidovými můstky. Získávají se reakcí Grignardových činidel (Mg(CH3)X) s chloridem platičitým v benzenu.
PdII a PtII tvoří vedle [ML2R2] (L = fosfan, R = alkyl) také katalyticky účinné komplexy s alkeny. K nejdéle známým komplexům platiny patří [PtCl2(C2H4)]2 (1827, W. C. Zeise) a K[PtCl3(C2H4)].H2O (1831, Zeiseho sůl). Známy jsou i komplexy [PtCl2(alken)]2, [PtCl3(alken)]− a analogické (poněkud reaktivnější) sloučeniny palladia, jejichž vznik se využívá ke katalytické oxidaci alkenů (směs PdCl2/CuCl2 ke katalytické oxidaci ethenu na acetaldehyd).