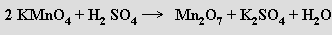
Oxid manganistý Mn2O7 (b. t. 6 °C; zahřátím na 95 °C exploduje) je tmavozelená olejovitá kapalina vznikající účinkem koncentrované kyseliny sírové na manganistany
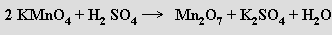
Jeho molekulu tvoří dva tetraedry MnO4 spojené vrcholem. (O3MnOMnO3). Nelze ho připravit přímo z prvků, už za laboratorní teploty se pomalu rozkládá za uvolnění kyslíku
Je anhydridem kyseliny manganisté HMnO4 schopné existence pouze v roztoku (lze ji připravit reakcí manganistanu barnatého s kyselinou sírovou). Oxidací technecia a rhenia na vzduchu vznikají těkavé hygroskopické kyselinotvorné oxidy rhenistý Re2O7 (v pevné fázi vrstevnatý polymer, v plynné monomer) a technecistý Tc2O7 (monomerní i v pevné fázi).
Z trioxidů je stálý pouze červený oxid rheniový ReO3 vznikající redukcí Re2O7 oxidem uhelnatým. Modrý oxid rheničný Re2O5 snadno disproporcionuje na oxidy rhenistý a rheničitý.
Kompletní řada oxidů existuje v oxidačním stavu +IV. Nejdůležitější z nich je oxid manganičitý MnO2, který se zahřátím (500 °C) rozkládá na kyslík a oxid manganitý. Oxid manganičitý je berthollidem a v hydratované formě (bez částečného rozkladu ho nelze úplně dehydratovat) má vlastnosti katexu. Slouží jako účinné oxidační činidlo (používá se v Leclanchéových suchých článcích), k odbarvování skla a k výrobě feritů (MnFe2O4). Horké kyseliny sírová a chlorovodíková s ním reagují za vzniku manganatých solí
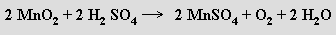
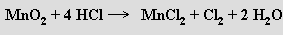
Termicky nejstabilnějším (sublimuje při 1000 °C) oxidem technecia je oxid technecičitý TcO2 vznikají cí termickým rozkladem technecistanu amonného

Méně stálý (zahřátím na 900 °C disproporcionuje na oxid rhenistý a rhenium) oxid rheničitý ReO2 se tvoří redukcí rhenistanů zinkem v prostředí kyseliny chlorovodíkové.
Existence oxidů v oxidačních stavech nižších než +IV je (s výjimkou Re2O3.2H2O) charakteristická pouze pro mangan. Směsný oxid manganatomanganitý Mn3O4 (MnIIMnIIIO4, minerál hausmannit) se strukturou spinelu vzniká při zahřívání (1000 °C) kteréhokoliv oxidu manganu. Oxid manganitý Mn2O3 s podobnou strukturou jako Mn3O4 (jediný z oxidů přechodných kovů se stechiometrií M2O3 nemá strukturu korundu) se tvoří oxidací roztoků manganatých solí vzdušným kyslíkem. Redukcí vyšších oxidů manganu vodíkem je možno připravit šedý až zelený antiferromagnetický oxid manganatý MnO.
Disulfid manganatý MnS2 se strukturou analogickou pyritu se zahříváním rozkládá na sulfid manganatý MnS známý v několika modifikacích (zelený, červený, růžová hydratovaná forma). Technecium a rhenium tvoří heptasulfidy M2S7 přecházející zahříváním na sulfidy MIVS2.
V halogenidech se nejvyšší oxidační stavy manganu, technecia i rhenia uplatňují vůči fluoru. Fluorid rhenistý ReF7 představuje jediný známý heptahalogenid, hexahalogenidy jsou známy tři (TcF6, ReF6, ReCl6) a pentahalogenidy čtyři (TcF5, ReF5, ReCl5, ReBr5). Všechny (s výjimkou ReF5 vznikajícího redukcí ReF6 wolframem) se dají připravit z prvků. Jsou to těkavé pevné barevné látky snadno podléhající hydrolýze. V oxidačním stavu +IV je známa kompletní řada halogenidů rheničitých a TcCl4 . Nejvyšším halogenidem manganu je fluorid manganičitý MnF4 (dostupný reakcí prvků) a také v oxidačním stupni +III je pevný červenofialový fluorid manganitý MnF3 (získá se působením fluoru na halogenidy manganaté) jediným známým halogenidem tohoto prvku. Kromě něho jsou popsány halogenidy rhenité Re3 X9 (X = Cl, Br, I) s charakterem klastrů. Jednoduché dihalogenidy jsou známy pouze u manganu. Fluorid manganatý MnF2 je ve vodě nerozpustný a netvoří hydráty, zbývající tři halogenidy manganaté MnX2 (X = Cl, Br, I) jsou rozpustné a běžně krystalují jako tetrahydráty. Oxid-halogenidy jsou početnější u technecia a rhenia než u manganu a oxidační stav kovu se v nich pohybuje od +V do +VII. U manganu jsou známy oxid-fluoridy a oxid-chloridy (explozívní kapaliny), u technecia a rhenia i oxid-bromidy (pevné látky, jejichž stabilita roste se zvyšujícím se oxidačním stavem prvku). Jejich společnou vlastností je snadná hydrolýza, informací o jejich struktuře je málo.
V alkalických roztocích může málo rozpustný hydroxid manganatý Mn(OH)2 existovat jen bez pří tomnosti kyslíku, jímž je rychle oxidován na tmavohnědý hydratovaný oxid manganitý případně až na černý hydratovaný oxid manganičitý. Soli manganaté jsou známy s mnoha anionty, jejich rozpustnost se podobá solím hořečnatým. V roztocích jsou běžné kationty hexaaquamanganaté [Mn(H2O)6]2+, krystalohydráty jsou obvykle růžové (MnCl2.4H2O, Mn(NO3)2.6H2O).
Soli manganité v roztoku samovolně disproporcionují
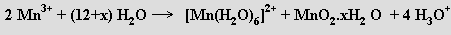
Stálé jsou jen nerozpustné sloučeniny manganité (hydratovaný oxid manganitý) a některé rozpustné soli s komplexními anionty ([MnF4]−, [Mn(CN)6]3−).
Při tavení s alkalickými hydroxidy se oxid manganičitý oxiduje vzdušným kyslíkem na tmavozelené, ve vodě rozpustné manganany
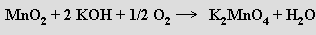
Ty jsou stálé jen v silně zásaditém prostředí, jinak rychle disproporcionují

Světle modré manganičnany MI3MnO4 vznikají redukcí silně alkalických roztoků mangananů (nebo manganistanů) siřičitany za chladu (0 °C). Při okyselení roztoku rychle disproporcionují
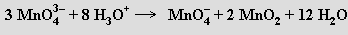
Pouze nejsilnější oxidovadla (oxid olovičitý, bismutičnany) jsou schopna v roztoku převést soli manganaté až na manganistany MIMnO4
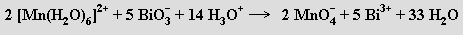
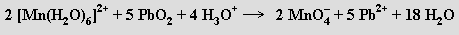
Manganistany jsou silnými oxidovadly v kyselém
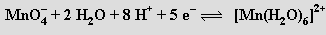
i zásaditém prostředí
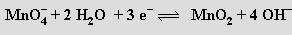
Oxidační vlastnosti manganistanu draselného se využívají ke kvantitativnímu odměrnému stanovení (manganometrie) železnatých solí, peroxidu vodíku a jiných redukujících látek
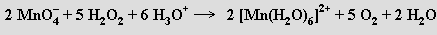
Manganometrická titrace probíhá zpočátku pomalu a její rychlost se výrazně zvýší po vzniku iontů manganatých (jde o typický příklad autokatalytické reakce, k indikaci ekvivalenčního bodu slouží vlastní zbarvení manganistanu draselného). Průmyslově je k výrobě manganistanů využívána elektrochemická oxidace mangananů. Bezbarvé technecistany MITcO4 a rhenistany MIReO4 se připravují snadněji než manganistany (oxidací sloučenin těchto kovů v nižších oxidačních stavech kyselinou dusičnou nebo peroxidem vodíku), protože jsou méně účinnými oxidačními činidly.
Z organokovových sloučenin se σ-vazbou M-C jsou nejpočetnější a nejrozmanitější sloučeniny rhenia. Re(CH3)6 poskytuje reakcí s LiCH3 pyroforický Li2[Re(CH3)8], stabilnější jsou sloučeniny obsahující vedle alkylu i kyslík ([ReO(CH3)4]). Mangan, technecium i rhenium tvoří po jednom diamagnetickém binárním karbonylu [M2(CO)10] (M = Mn, Tc, Re) a mnoho komplexů s nehomogenní koordinační sférou. Manganocen [Mn(C5H5)2] je analogem ferrocenu, obdobné sloučeniny technecia a rhenia známy nejsou (pouze se dvěma neparalelními kruhy, hydridickým vodíkem a s kovem v oxidačním stavu +III).