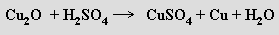
Hydrid měďný CuH (červenohnědý) vzniká v nečisté formě redukcí vodného roztoku síranu měďnatého kyselinou fosfornou.
Acetylidy měďný Cu2C2 a stříbrný Ag2C2 jsou v suchém stavu výbušné, působením kyselin se z nich uvolňuje acetylen. Explozívní nitridy stříbra Ag3N a zlata Au3N (třaskavé stříbro resp. zlato) se vylučují z amoniakálních roztoků oxidů obou kovů. Snadno se tvoří i stejně nestabilní azidy mědi a stříbra.
Ve vodě nerozpustný oxid měďný Cu2O (žlutý nebo červený) vzniká redukcí sloučenin měďnatých slabšími redukovadly (hydrazin, cukry) a jeho vznik je podstatou Fehlingovy zkoušky na přítomnost cukrů. Ve zředěných kyselinách snadno disproporcionuje
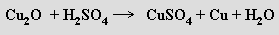
Výrazně bazický oxid stříbrný Ag2O vzniká dehydratací nestálého hydroxidu stříbrného AgOH už ve vodném roztoku. Zahříváním nad 160 °C se rozkládá na své komponenty.
Oxid měďnatý CuO (černý) se připravuje termickým rozkladem dusičnanu nebo hydroxidu měďnatého. Rozpouští se v kyselinách na soli měďnaté a v hydroxidech na tetrahydroxoměďnatany MI2[Cu(OH)4]2−. Při vyšších teplotách (1000 °C) se rozkládá na oxid měďný a kyslík. Koordinace kationtů měďnatých v jeho mřížce je deformovaně oktaedrická.
Oxid stříbrnatý AgO se silnými oxidačními vlastnostmi se připravuje elektrolýzou roztoku dusičnanu stříbrného nebo reakcí peroxodisíranu s dusičnanem stříbrným. Rentgenografické studium ukázalo, že je nutno ho formulovat jako oxid stříbrnostříbřitý AgIAgIIIO2. Je znám i kovově vodivý suboxid o složení Ag3O.
Jediným dobře definovaným oxidem zlata je oxid zlatitý Au2O3 (dříve deklarovaný oxid zlatný Au2O obsahoval AuI i AuIII), který se v hydratované formě Au2O3.xH2O vylučuje z vodných roztoků zlatitých solí působením hydroxidů alkalických kovů. Lze ho termicky dehydratovat, při teplotě nad 160 °C se rozkládá na své komponenty. V roztocích hydroxidů alkalických kovů se rozpouští za vzniku tetrahydroxozlatitanů MI[Au(OH)4].
Sulfid měďný Cu2S (v důsledku defektní krystalové struktury jeho složení lépe vystihuje vzorec Cu9S5) vzniká přímou reakcí prvků nebo redukcí sulfidu měďnatého vodíkem. Extrémně málo rozpustný sulfid stříbrný Ag2S (nerozpouští se ani ve vodném roztoku amoniaku nebo thiosíranu) se tvoří přímou reakcí prvků nebo srážením roztoků stříbrných solí sulfánem. Je jediným známým sulfidem stříbra. Sulfid zlatný Au2S se sráží sulfánem z roztoků zlatných komplexů (např. dibromozlatnanu draselného K[AuBr2]).
Sulfid měďnatý CuS je černá nerozpustná látka, která se z vodných roztoků měďnatých solí sráží sulfánem a na vlhkém vzduchu se pomalu oxiduje na síran. Ve skutečnosti nejde o jednoduchou sloučeninu, ale o sulfid-disulfid diměďno-měďnatý CuI2CuII(S2)S). Sulfid zlatitý Au2S3 lze získat reakcí chloridu zlatitého se sulfánem v diethyletheru (přídavek vody vede k rychlé redukci na AuI).
Nestabilní fluorid zlatičný AuF5 vzniká opatrným termickým rozkladem hexafluorozlatičnanu dioxygenylu O2+AuF6− a snadno se rozkládá na fluorid zlatitý a fluor. Oranžový fluorid zlatitý AuF3 má řetězovitou polymerní strukturu, v níž čtvercově planární jednotky AuF4 vzájemně sdílejí vždy dva fluorové atomy v cis-poloze. Chlorid AuCl3 a bromid zlatitý AuBr3 (červenohnědé, snadno sublimující látky) se připravují reakcemi prvků. V pevném i plynném skupenství jsou tvořeny planárními dimery Au2X6 (X = Cl, Br) s můstkovými atomy halogenu. Chlorid zlatitý s vodou poskytuje kyselinu hydroxotrichlorozlatitou H[Au(OH)Cl3], kterou lze přídavkem kyseliny chlorovodíkové převést na kyselinu tetrachlorozlatitou HAuCl4 (její tetrahydrát tvoří žluté jehlice o složení H3O+ [AuCl4]−.3H2O; její nejznámější solí je zlatá sůl Na[AuCl4].4H2O). Jodid zlatitý AuI3 není znám.
Fluorid CuF2 (v bezvodé formě bílý), chlorid CuCl2 (žlutohnědý) a bromid měďnatý CuBr2 (černý) se z vodných roztoků vylučují jako modře až zeleně zbarvené dihydráty CuX2.2H2O. V jejich koncentrovaných roztocích se tvoří jedno- i vícejaderné komplexy (Cu[CuCl4], [Cu2 Cl6]2−). Jodid měďnatý CuI2 není schopen existence, protože jodidy redukují CuII na CuI (přídavek jodidu alkalického kovu do roztoku měďnaté soli způsobí vznik nerozpustného jodidu měďného a jodu). Fluorid stříbrnatý AgF2 (jediný halogenid stříbrnatý, halogenidy zlatnaté nejsou známy vůbec) se připravuje zahříváním stříbra v proudu fluoru. Je to termicky stabilní látka se silnými fluoračními účinky.
Ve vodě prakticky nerozpustné halogenidy měďné CuX (X = Cl, Br, I; fluorid měďný není znám) se srážejí z roztoků měďnatých solí účinkem redukovadel. V roztocích obsahujících nadbytek halogenidů se rozpouštějí za tvorby komplexních halogenoaniontů měďných. Halogenidům jsou blízce příbuzné kyanid a thiokyanatan měďný. Bezbarvý a ve vodě velmi dobře rozpustný (1800 g.l-1) fluorid stříbrný AgF se připravuje rozpouštění oxidu stříbrného v kyselině fluorovodíkové (krystaluje jako dihydrát, který už při 40 °C ztrácí vodu). Chlorid AgCl, bromid AgBr i jodid stříbrný AgI jsou ve vodě nerozpustné a připravují se přídavkem příslušného halogenidu alkalického kovu do roztoku dusičnanu stříbrného. Je pro ně charakteristická citlivost ke světlu využívaná ve fotografii. Fluorid zlatný AuF není znám, chlorid AuCl a bromid zlatný AuBr vznikají opatrným termickým rozkladem příslušných trihalogenidů, jodid zlatný AuI (řetězovitý polymer s koordinačním číslem zlata dvě) přímou reakcí prvků.
Amfoterní hydroxid zlatitý Au(OH)3 se tvoří srážením rozpustných komplexů chlorozlatitých alkalickými hydroxidy a snadno jej lze dehydratovat na oxid zlatitý. V nadbytku alkalického hydroxidu se rozpouští za vzniku tetrahydroxozlatitanů MI[Au(OH)4].
Jasně modrá sraženina amfoterního hydroxidu měďnatého Cu(OH)2 se tvoří působením hydroxidů alkalických kovů na roztoky solí měďnatých. Snadno se rozpouští v kyselinách za vzniku příslušných solí i v nadbytku hydroxidu za vzniku tetrahydroxoměďnatanů MI2[Cu(OH)4]. Ve vodném roztoku amoniaku přechází na hydroxid tetraamminměďnatý [Cu(NH3)4](OH)2 (Schweizerovo činidlo) používané k rozpouštění celulózy.
Dusičnan měďnatý Cu(NO3)2 se v bezvodé formě připravuje obtížně, jeho hydráty snadno. Pentahydrát síranu měďnatého CuSO4.5H2O (modrá skalice) lze dehydratovat na bezbarvý hygroskopický bezvodý síran měďnatý. Z měďných solí oxokyselin je nejběžnější síran měďný Cu2SO4. Ve vodě velmi dobře rozpustný dusičnan stříbrný AgNO3 slouží jako výchozí surovina pro přípravu dalších stříbrných sloučenin. Připravuje se rozpouštění m stříbra v koncentrované kyselině dusičné

Komplexní sloučeniny s oxidačním stavem kovu vyšším než +III jsou u mědi, stříbra a zlata málo početné ([AuVF6]−, [CuIVF6]2−). Komplexy mědité podléhají snadno redukci, ale protože mají význam v některých biochemických systémech, věnuje se jejich studiu značná pozornost. Jediným vysokospinovým komplexem tohoto typu je MI3[CuF6], ostatní jsou nízkospinové se čtvercovou geometrií koordinační sféry. Vysoce reaktivní jsou halogenokomplexy stříbřité (MI[AgF4]), stálejší jsou naopak komplexy s O-donorovými ligandy (jodistany, tellurany). U zlata je oxidační stav +III nejstálejší a často jsou jeho komplexy srovnávány s izoelektronovými sloučeninami platnatými (na rozdíl od PtII existují u AuIII tetrafluorokomplexy a koordinovány jsou i O-donorové ligandy jako OH−). V aniontu tetranitrátozlatitanovém [Au(NO3)4]− se dusičnanové anionty uplatňují jako jednofunkční ligandy.
V oxidačním stavu +II jsou nejpočetnější komplexy měďnaté. Poměrně málo sloučenin obsahuje kation hexaaquaměďnatý [Cu(H2O)6]2+ (chloristan, dusičnan), z amminkomplexů jsou běžné kationty tetraamminměďnaté [Cu(NH3)4]2+ (hexaamminkomplexy [Cu(NH3)6]2+lze získat z kapalného amoniaku a známy jsou i pentamminderiváty vznikající v koncentrovaném vodném roztoku amoniaku, které pátou molekulu amoniaku snadno uvolňují). V alkalickém roztoku tvoří kationty měďnaté s biuretem (HN(CONH2)2) charakteristicky fialově zbarvené komplexy, jejichž vznik je podstatou biuretové zkoušky na přítomnost bílkovin. Struktura halogenidových komplexů je závislá na charakteru kationtu. MI[CuCl3] (M = NH4, Li, K) obsahují červené anionty [Cu2Cl6]2−, zatímco Cs[CuCl3] tvoří řetězce, v nichž oktaedry CuCl6 sdílejí protilehlé stěny. Struktura aniontu [CuCl4]2− se podle kationtu mění od čtvercově planární po deformovaně tetraedrickou a koordinační sféra v [CuCl5]3− může mít tvar trigonální bipyramidy nebo čtvercové pyramidy. Sloučeniny stříbrnaté mají většinou čtvercové uspořádání. Hydratované kationty stříbrnaté vznikají oxidací AgI ozonem a mají silné oxidační účinky (silnější než manganistany). Stabilizují je anionty bez redukčních schopností (dusičnany, fosforečnany, chloristany). Většina sloučenin považovaných dříve za komplexy zlatnaté obsahuje zlato v oxidačních stavech +I a +III (Cs2[AuICl2][AuIIICl4], AuIAuIII(SO4)2). Skutečných komplexů zlatnatých je známo málo, většinou obsahují S-donorové ligandy.
Ion měďný lze nejsnáze stabilizovat koordinací ligandů s π-akceptorovými schopnostmi za tvorby tetraedrických komplexů ([Cu(CN)4]3−, [Cu(py)4]+, jsou známy i komplexy s nižšími koordinačními čísly mědi). V lineárním aniontu dichloroměďnanovém [CuCl2]− má měď koordinační číslo dvě a v trojúhelníkovém polymerním aniontu trikyanoměďnanovém (v K2[Cu(CN)3]) koordinační číslo tři (diskretní planární anionty existují v Na2[Cu(CN)3].3H2O). Mnoho komplexů měďných má oligomerní charakter (kubanové nebo židličkové komplexy typu [CuXL]4, X = halogen, L = fosfan). Atomy mědi jsou v nich umístěny ve vrcholech tetraedru (nejsou spojeny vazbami kov - kov) a můstkové atomy halogenů leží nad jeho stěnami.
Pro komplexy stříbrné je tetraedrická koordinace zcela atypická (výjimkou jsou tetramerní komplexy [AgXL]4, X = halogen, L = fosfan) a O-donorové ligandy jsou řídké. Ve vodných roztocích stříbrných solí jsou přítomny kationty diaquastříbrné [Ag(H2O)2]+, rozpustnost halogenidů stříbrných v amoniakálních roztocích je založena na tvorbě kationtu diamminstříbrného [Ag(NH3)2]+. V roztoku thiosíranů se tvoří anionty bis(thiosulfato)stříbrnanové [Ag(S2O3)2]3−. Polymerní charakter mají některé jednoduché soli jako kyanid AgCN a thiokyanatan stříbrný AgSCN (lineární resp. lomené řetězce). Také AuI přednostně uplatňuje koordinační číslo dvě ([Au(CN)2]−), při koordinaci dává přednost těžším donorovým atomům (P, S). V dimerních komplexech AuI s dithiokarbamáty se uplatňují vazby kov-kov. Tvorba rozmanitě zbarvených kovových klastrů s průměrným oxidačním číslem kovu menším než jedna ([Au6 (PR3)6]2+, [Au8(P(C6 H5)3)8]2+, [Au9(PR3)8]3+) je typická pro zlato, v poslední době byla připravena i řada analogických sloučenin mědi ([Cu5Ph6]−). Získávají se obvykle redukcí fosfanhalogenidových komplexů tetrahydroboratem alkalického kovu.
Žádný z prvků 11. skupiny netvoří binární karbonyly (měď a zlato poskytují nestálé halogenokarbonyly [MCl(CO)] (M = Cu, Au)). Stabilita jednoduchých alkyl- a arylderivátů je větší u CuI než u AgI, s AuI se je dosud nepodařilo připravit. Alkylderiváty AuIII jsou naproti tomu známy už téměř 100 let (stálejší než AuR3 jsou AuR2X (X = halogen)) a zlato v nich polymerací dosahuje koordinační číslo čtyři ve čtvercově planárním uspořádání.