Borax Na2[B4O5(OH)4].8H2O byl používán již ve starověku k výroba emailů a tvrdých skel. Bor v nečisté formě izolovali H. Davy, J. L. Gay-Lussac a L. J. Thénard (1808). Mezinárodní název byl navržen tak, aby vyjadřoval zdroj prvku i jeho podobnost s uhlíkem - bor(ax + carb)on. Velmi čistý bor je produktem až 20. století. Je vzácným prvkem jak ve vesmíru, tak i v zemské kůře (9 ppm, podobně jako olovo 13 ppm, praseodym 9,1 ppm a thorium 8,1 ppm). Má dva stabilní izotopy 10B a 11B, jejichž poměr se v přírodním materiálu sice málo, ale přece jen liší podle naleziště, což znemožňuje uvádět relativní atomovou hmotnost boru přesněji než na dvě desetinná místa (10,81). Oba izotopy mají nenulový jaderný spin (mohou být využity v NMR spektroskopii) a značně rozdílný účinný průřez pro absorpci neutronů, což umožnilo vypracovat metody jejich separace v průmyslovém měřítku.
V přírodě se bor vyskytuje jen v podobě kyslíkatých sloučenin v poměrně vzácných ložiscích. Jeho nejdůležitějšími minerály jsou kernit Na2O.2B2O3.4H2O, borax Na2[B4O5(OH)4].8H2O, colemanit 2CaO.3B2O3, boracit 6MgO.8 B2O3.MgCl2 a sassolin H3BO3.
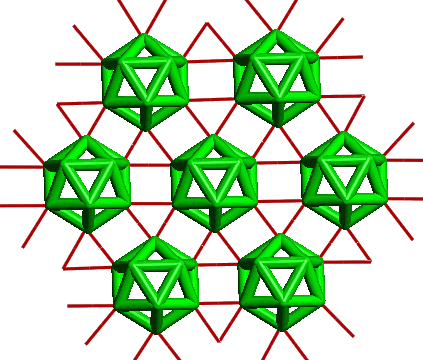
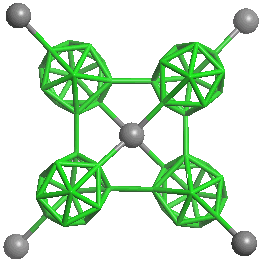
Bor existuje v amorfní (hnědé až černé) a několika krystalických (v procházejícím světle tmavočervených) modifikacích se složitou strukturou. Krystalický bor je inertní, proti žáru mimořádně stálý prvek s velmi malou elektrickou vodivostí. Amorfní bor má přibližně stejnou hustotou jako krystalické modifikace, je však při vyšších teplotách reaktivnější. Základním strukturním motivem krystalických modifikací je ikosaedrický skelet B12, v němž je každý atom boru vázán s pěti sousedními atomy polycenterními elektronově deficitními vazbami. Jednotlivé modifikace se liší způsobem uspořádání ikosaedrů, mezi nimiž se uplatňují slabší vazebné interakce než v rámci ikosaedru B12. Nejstabilnější je β-rhomboedrická (trigonální) modifikace boru (ρ = 2,35 g.cm-3, b. t. 2180 °C, b. v. 3650 °C). Je to černá lesklá a mimořádně tvrdá (>9 v Mohsově stupnici) látka. Nejjednodušší krystalovou strukturu má α-rhomboedrický bor (ρ = 2,45 g.cm-3), v jehož elementární buňce je umístěn jediný ikosaedr B12. β-rhomboedrická modifikace obsahuje v elementární buňce 105 a β-tetragonální (čtverečná) 192 atomů boru. První připravená modifikace boru (1943, α-tetragonální), jejíž elementární buňka obsahuje padesát atomů boru, se ukázala být podle podmínek přípravy buď B50C2 nebo B50N2.
|
Model struktury B12
|

α-rhomboedrický bor
|

α-tetragonální bor
|
Ve sloučeninách je bor vázán výhradně kovalentními vazbami, nejčastěji uplatňuje oxidační stupeň +III, velmi zřídka +II (B2Cl4, H4B2O4) a +I (BnCln). Kationty B3+nejsou vzhledem k malému rozměru atomu boru a vysokým hodnotám prvních tří ionizačních energií (jsou podstatně vyšší než u ostatních prvků této skupiny) schopny existence. Elektronegativita boru (2,0) je blízká křemíku a germaniu (1,8), ale nižší než uhlíku (2,5) a vodíku (2,1). Polarita (velmi malá) vazeb B-H resp. C-H je proto obrácená (téměř nepolární jsou vazby B-H a B-X (X = Br, I)). Typická je σ-hybridizace sp2 s volným 2pz-orbitalem, který může být využit k tvorbě delokalizovaných π-vazeb, jejichž existence se předpokládá i v trihalogenidech boritých. V molekulách BX3 jsou atomy boru koordinačně nevysycené a existuje proto řada aduktů s donorovými molekulami typu BX3.D a aniontů BX4−. V některých sloučeninách se atomy boru mohou vyskytovat v různých hybridních stavech (sp2 a sp3 v aniontu [B4O5(OH)4]2−). V borazolu B3N3H6, aniontu trimetaboritanovém B3O63− a nitridu boritém BN se uplatňují delokalizované π-vazby benzenového nebo grafitového typu. Typickým jevem v chemii boru je existence polycentrických elektronově deficitních vazeb, které hrají významnou roli ve struktuře elementárního boru, boridů, boranů a jejich derivátů. Úsilí o vysvětlení vazebných poměrů v těchto sloučeninách vedlo k rozpracování popisu polycenterních elektronově deficitních vazeb metodami teorie molekulových orbitalů.
Za laboratorní teploty reaguje bor pouze s fluorem a na povrchu i s kyslíkem. Za vysokých teplot se slučuje s většinou kovů (mimo některé těžší prvky d-bloku), nekovů i polokovů (s výjimkou vodíku, germania, telluru a vzácných plynů). Neoxidující kyseliny na něj nepůsobí, do 500 °C odolává roztaveným alkalickým hydroxidům. Kyselina dusičná a sírová ho za horka oxidují, rozpouští se v taveninách směsí hydroxidů a uhličitanů alkalických kovů (900 °C).
Čistý krystalický bor lze připravit redukcí bromidu boritého vodíkem na elektricky vyhřívaném tantalovém vlákně (pod 1000 °C amorfní, mezi 1000 a 1200 °C α- a β-rhomboedrický a při vyšší teplotě tetragonální). Amorfní (poněkud znečištěný) bor vzniká redukcí oxidu boritého hořčíkem, vápníkem nebo sodíkem. Použitelná je i elektrolýza tavenin boritanů nebo fluoroboritanů a tepelný rozklad boranů nebo halogenidů boritých.
Elementární bor se ve formě vláken s wolframovým jádrem používá v letecké a raketové technice. Ze sloučenin boru se průmyslově se vyrábějí oxid boritý, kyselina boritá a její estery, boritany, boridy (žáruvzdorné materiály), halogenidy borité, borany a karborany. Uplatňují se při výrobě pracích prášků (využívá se bělicích účinků peroxoboritanu sodného při teplotě vyšší než 90 °C), kosmetiky, tvrdých skel (Pyrex), porcelánových polev a smaltů.