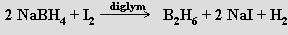
Boridy představují skupinu více než dvou set sloučenin boru s kovy. Zpravidla mají složitou stechiometrii (od M5B až po MB66, známy jsou i fáze obsahující více než jeden druh kovu) a v jejich struktuře se významně uplatňují polycentrické elektronově deficitní vazby. Atomy boru v nich mohou být izolované, vzájemně spojené do řetězců, šestiúhelníkových vrstev nebo trojrozměrných uskupení. V boridech MB6 se v rozích krychlí nacházejí oktaedry B6 vzájemně propojené přes vrcholy, ve středu krychlí jsou atomy kovu koordinovány čtyřiadvaceti atomy boru.
V boridech MB12 nemají jednotky B12 strukturu ikosaedru, ale kubooktaedru.
Boridy bohaté na kov jsou velmi tvrdé, žáruvzdorné, chemicky inertní a mají vysoké body tání. Zpracovávají se proto technikami práškové metalurgie, některé z nich se vyznačují velmi dobrou elektrickou a tepelnou vodivostí (často lepší než matečné kovy). K jejich přípravě lze využít přímé slučování prvků, elektrolytické vylučování z roztavených solí (zejména MB6) a redukce oxidů kovů karbidem boru B4C. Existují pestré možnosti jejich využití (vnitřní plochy raketových trysek, nádoby pro zpracování roztavených kovů, elektrody a kontrolní tyče v jaderných reaktorech).
Binární sloučeniny boru s vodíkem se nazývají borany. V posledních třech desetiletích byla jejich chemie jednou z nejrychleji se rozvíjejících oblastí chemie nekovů. Borany jsou bezbarvé diamagnetické molekulární sloučeniny s malou až střední tepelnou stabilitou. Nižší homology jsou za laboratorní teploty plynné, s rostoucí molekulovou hmotností přecházejí na těkavé kapaliny až pevné látky. Všechny jsou v důsledku mimořádné pevnosti vazeb v elementárním boru a divodíku (nikoliv slabosti vazby B-H) velmi reaktivními endotermickými sloučeninami (s rostoucí molekulovou hmotností reaktivita klesá). Dosud bylo charakterizováno více než 50 elektroneutrálních molekul BnHm a ještě větší počet anionických částic BnHmx−.
Princip názvosloví boranů je jednoduchý. Počet atomů boru se uvede latinskou číslovkou jako předpona, počet vodíkových atomů arabskou číslicí v závorce za názvem. Strukturní informace (název strukturního typu podle výše uvedeného přehledu) lze doplnit jako kursivou psaný deskriptor (předponu oddělenou pomlčkou). Složitější je názvosloví derivátů boranů vyžadující pečlivé dodržování pravidel pro číslování skeletů. Pro označování aniontů se používá podle doporučení IUPAC názvu boraty, vodíkovým atomům je vyhrazena předpona hydro (tetrahydroborat lithný LiBH4), přestože to není konsistentní s platným českým názvoslovím ostatních anorganických sloučenin.
První borany (B2H6, B4H10, B5 H9, B5H11 a B10H14) izoloval A. Stock (1914-1920) z plynných produktů reakce boridu hořečnatého MgB2 se zředěnou kyselinou chlorovodíkovou (tohoto úspěchu dosáhl vyvinutím techniky vakuových linek pro práci s těkavými a k vlhkosti či kyslíku citlivými látkami). Pro preparativní účely se dnes již této reakce neužívá a výchozí látkou pro přípravu vyšších boranů je obvykle diboran. K jeho přípravě je k dispozici několik vhodných reakcí (k jejich realizaci se často jako rozpouštědlo využívá polyether diglym CH3 OCH2CH2OCH2CH2OCH3)
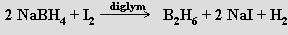
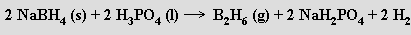
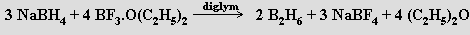
Průmyslově se diboran připravuje redukcí fluoridu boritého alkalickým hydridem
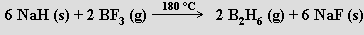
Vodou se diboran rozkládá za uvolnění vodíku
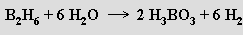
s halogenovodíky tvoří halogenoderiváty
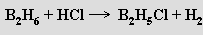
a reakce s halogeny vede k halogenidům boritým
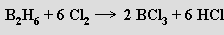
S donory typu CO, PF3 nebo trimethylaminu se snadno tvoří DA-komplexy, reakcí s amoniakem vzniká komplex [H2B(NH3)2]+[BH4]−, který zahřátím přechází na cyklický borazol B3N3H6.
Nejjednodušší nabitou částicí odvozenou od boranu je anion tetrahydroboratový BH4−, existující v kombinaci s mnoha kationty. Alkalické tetrahydroboraty lze připravit řadou reakcí
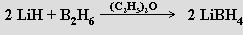
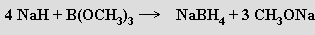
V tetrahydroboratu beryllnatém Be(BH4)2 a hlinitém Al(BH4)3 jsou skupiny BH4 spojeny s atomy kovu třícenterními vazbami. Roztoky tetrahydroboratů se používají jako silná redukovadla a zdroj hydridových aniontů.
Prvním úspěchem při studiu struktury boranů bylo rentgenografické stanovení struktury dekaboranu(14) (B10H14, 1948). Uspokojivý popis vazebných poměrů byl umožněn zavedením představy třístředových dvouelektronových vazeb B-H-B (C. Longuet-Higgins, 1949). Následoval důkaz přítomnosti dvou vodíkových můstků v diboranu a stanovení struktury B5H9 (1951).
Představy o struktuře této skupiny sloučenin rozvinul W. N. Lipscomb (Nobelova cena 1976). V současné době se soudí, že se v chemii boranů uplatňuje vedle třístředových vazeb B-H-B pouze uzavřená třícenterní vazba B-B-B. (otevřené vazby B-B-B jsou užitečné pro popis vazby v karboranech a heteroatomových klastrech). Vazebné poměry v boranech se charakterizují čtyřmístným číslem nazývaným parametr styx, v němž s je počet vazeb B-H-B, t počet třístředových vazeb B-B-B, y počet dvoustředových vazeb B-B a x počet skupin BH2. Podle struktury lze borany rozdělit do pěti skupin
closo-borany (closo z clovo = klec) BnHn+2 mají uzavřené klastry z n atomů boru. Nenabité molekuly nejsou známy, pouze anionty BnHn2− (n = 6 až 12; jejich chemické chování vedlo k představě o trojrozměrné aromaticitě). Lze je připravit pyrolýzou diboranu za přesně definovaných podmínek (vyšší teplota a katalýza ethery vedou k větším aniontům, mechanismy reakcí nejsou dosud detailně známy)
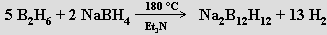
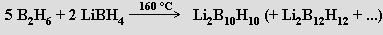
Termickou stabilitou a malou reaktivitou vynikají soli vysoce symetrických aniontů B10H102− a B12H122−, které se nerozkládají zahřátím na 600 °C, odolávají nukleofilním atakům a jsou jen mírně citlivé k elektrofilnímu napadení. U jejich derivátů se uplatňuje izomerie (B10H9X2− má dva, B10H7X3,2− šestnáct izomerů).
|
Anion B10H102−
|
Anion B12H122−
|
V nido-boranech (nidus = hnízdo) BnHn+4 obsazuje klastr Bn n vrcholů (n+1)-vrcholového mnohostěnu (B2H6, B5H9, B6H10, B10H14). Odstraněním můstkových atomů vodíku vznikají jednou (BnHn+3−, B5H9−, B10H13−) i dvakrát (BnHn+22−, B10H122−, B11H132−) nabité anionty. Formálně k tomuto typu patří i aniont BH4−, který je možno považovat za produkt adice H− na BH3.
nido-pentaboran(9) B5H9 (b. v. 60 °C) je termicky poměrně stálá, reaktivní, na vzduchu samozápalná kapalina. Atomy boru vytvářejí v jeho molekule tetragonální pyramidu, každý z nich nese jeden terminální atom vodíku a hrany čtvercové základny představují můstkové vazby B-H-B. S Lewisovými bázemi tvoří adukty, z nichž některé byly identifikovány jako členy hypho-boranové řady BnHn+8. Současně s tvorbou DA-vazby dochází i k nečekaně rozsáhlé reorganizaci atomů vodíku (ligand v [B5H9((CH3)2NCH2CH2N(CH3)2)] koordinuje jen jeden atom boru, který se zbytkem skeletu zůstává spojen jedinou vazbou B-B). nido-pentaboran(9) je slabou Brönstedovou kyselinou (kyselost obecně roste s velikostí boranového klastru), protože působením silných bazí (LiCH3, MH) za nízké teploty ztrácí jeden z můstkových vodíků

Reakcí M+B5H8− s chloroderiváty fosforu, křemíku nebo boru lze získat v můstku substituované deriváty nido-B5 H9.
nido-dekaboran(14) B10H14 je nejlépe prostudovaným vyšším boranem (v 50. letech se v USA vyráběl v tunových množstvích jako potenciální vysokoenergetické palivo). Je to bezbarvá těkavá krystalická látka nerozpustná ve vodě, ale dobře rozpustná v organických rozpouštědlech. Laboratorně se připravuje opatrnou pyrolýzou diboranu (100-200 °C, katalyzátor dimethylether). Ve vodně-alkoholických roztocích ho lze titrovat jako jednosytnou kyselinu (pKa = 2,70)
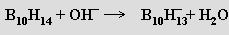
Anionty odvozené od nido-B10H14 lze připravit jeho reakcí a alkalickými kovy v etherech nebo kapalném amoniaku (současně dochází ke změně strukturního typu skeletu z nido- na arachno-)
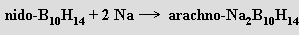
arachno-borany (arachne = pavučina) BnHn+6 mají otevřenější struktury, v nichž klastr Bn obsazuje n vzájemně sousedících vrcholů (n+2)-vrcholového mnohostěnu (B4H10, B5H11 , B6H12, B9H15). Jsou známy anionty BnHn+5− (B2H7−, B3H8−, B5H10−, B10H15−) i BnHn+42− (B10H142−). Arachno-borany jsou obecně reaktivnější a kyselejší než nido-borany.
|
nido-dekaboran(14)
|
arachno-tetraboran(10)
|
arachno-pentaboran(11)
|
hypho-borany (hyphe = síť) BnHn+8 mají nejotevřenější struktury, v nichž klastr Bn obsazuje n sousedících vrcholů (n+3)-vrcholového mnohostěnu (B8H16, B10H18).
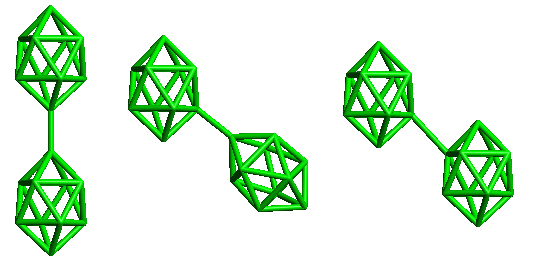
conjuncto-borany (conjuncto = spojuji) vznikají spojením dvou nebo více předchozích typů klastrů. Dosud je známo pět typů takových spojení (sdílení jednoho až čtyř atomů B nebo vytvoření dvoustředové σ-vazby B-B mezi dvěma klastry). Oxidací B10H102− lze připravit tři izomery conjuncto-B20H184−.