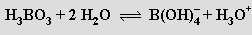
Kyselina trihydrogenboritá H3BO3 (orthoboritá) tvoří perleťově bílé šupinkovité krystaly, jejichž rozpustnost ve vodě silně vzrůstá s teplotou. Připravuje se působením kyseliny chlorovodíkové nebo sírové na roztok tetraboritanu sodného. V měkkých a podél vrstev snadno štípatelných krystalech jsou planární molekuly H3BO3 uspořádány do vrstev (se šestiúhelníkovou výstavbou) vzájemně poutaných vodíkovými můstky. H3BO3 je velmi slabou pouze jednosytnou kyselinou (pKa = 9,25) působící výhradně jako akceptor aniontu OH−
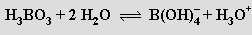
V bezvodé kyselině sírové se kyselina orthoboritá chová jako silná kyselina:
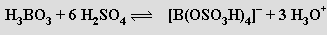
Kyselost roztoků kyseliny borité se podstatně zvyšuje přídavkem organických sloučenin s větším počtem skupin OH (glycerin, mannit). Jako silné kyseliny se chovají vznikající cheláty, které umožňují titrační stanovení kyseliny orthoborité. Působením methanolu v přítomnosti koncentrované kyseliny sírové na kyselinu orthoboritou se tvoří její těkavý trimethylester B(OCH3)3
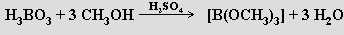
Jeho hoření provázené zeleným zbarvením plamene se využívá k důkazu boru.

[Zobrazit video]
|
Trimethylester kyseliny borité hoří zeleným plamenem |
Zahřátím nad 100 °C se kyselina trihydrogenboritá dehydratuje na kyselinu hydrogenboritou (metaboritou) (HBO2)n známou ve třech krystalových modifikacích (orthorhombické, monoklinické a kubické) lišících se svými stavebními jednotkami, hustotou i koordinačními čísly atomů boru (3, 3 i 4, 4). Dalším zahříváním přechází kyselina metaboritá na oxid boritý.
Základními stavebními jednotkami boritanů jsou trigonálně planární skupiny BO3 a tetraedrické jednotky BO4, které se prostřednictvím kyslíkových atomů spojují v polymerní řetězce nebo cykly (struktura a zákonitosti jejich výstavby jsou podobné jako u křwemičitanů). Orthoboritany s izolovanými anionty BO33− jsou řídké (LnIIIBO3, Mg3(BO3)2), diboritanové anionty B2O54− byly zjištěny v CoIB2O5, Mg2B2O5 a Fe2B2O5. cyklo-triboritany (trimetaboritany) alkalických kovů MI3B3O6 jsou tvořeny šestiúhelníkovými anionty (strukturně analogickými borazolu) s delokalizovanými π-vazbami.
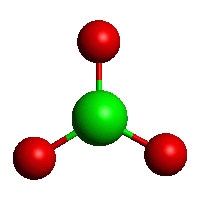
[BO3]3−
|
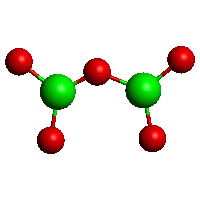
[B2O5]4−
|
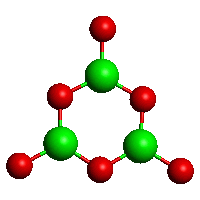
[B3O6]3−
|
Metaboritany kovů alkalických zemin MII(BO2)2 obsahují nekonečné řetězce (BO2)nn−. Tetraedrické jednotky BO4 existují v TaVBO4, strukturně analogické anionty tetrahydroxoboritanové [B(OH)4]− jsou přítomny v Na2 [B(OH)4]Cl.
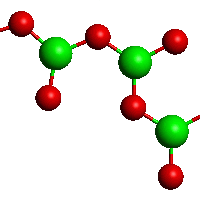
[(BO2)]nn−
|
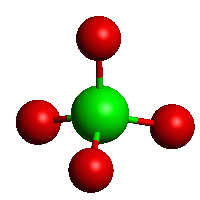
[BO4]4−
|
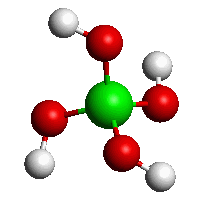
[B(OH)4]−
|
Hydratované polyboritany typu dihydrátu pentaboritanu draselného K[B5O6(OH)4].2H2O nebo oktahydrátu tetraboritanu disodného Na2[B4O5(OH)4].8H2O jsou tvořeny skupinami BO3 i BO4. Připravují se reakcemi kyseliny orthoborité s hydroxidy alkalických kovů v roztoku nebo tavením kyseliny orthoborité s oxidy nebo hydroxidy kovů (často vznikají ve sklovitém stavu). Vzdálenosti B-O v tě chto rozmanitých strukturách se mění ve značném rozmezí a obecně rostou se zvyšujícím se koordinačním číslem boru (B=O 120 pm, B-O v BO3 128-143 pm a v BO4 143-155 pm). Ve vodě jsou rozpustné jen boritany alkalických kovů. Jejich roztoky reagují v důsledku hydrolýzy silně alkalicky, krystalují obvykle jako hydráty. Pro praxi významný borax Na2[B4O5(OH)4].8 H2O (často nesprávně formulovaný jako dekahydrát Na2B4O7.10H2O) tvoří bezbarvé krystaly, které na vzduchu zvě trávají a při zvýšené teplotě (350 až 400 °C) zcela dehydratují. Sklovitá tavenina boraxu rozpouští mnoho kovových oxidů za vzniku charakteristicky zbarvených boraxové perličky využívaných v kvalitativní analýze. Borax se používá i při výrobě smaltovaných nádob a optických skel, úpravě glazur na keramiku a při pájení kovů.
Peroxoboritan sodný Na2[B2(O2)2(OH)4].6H2O (NaBO3.4 H2O) vzniká účinkem peroxidu vodíku na boritan sodný nebo peroxidu sodného na kyselinu orthoboritou a obsahuje dvě můstkové peroxoskupiny -O-O-. Ve vodném roztoku snadno uvolňuje peroxid vodíku a používá se proto jako bělicí složka pracích prostředků.
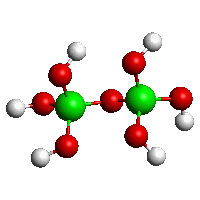
[B2O(OH)6]2−
|
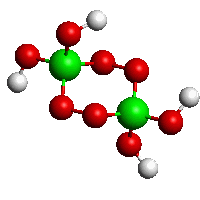
[B2(O2)2(OH)4]2−
|
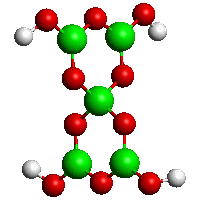
[B5O6(OH)4]−
|
|
[B3O3(OH)5]2−
|
[B4O5(OH)4]2−
|