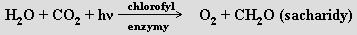
Kyslík byl připraven C. W. Scheelem (1773, termickým rozkladem ně kterých dusičnanů nebo oxidu stříbrného) a současně i J. Priestleym (rozkladem oxidu rtuťnatého; je pravděpodobné, že byl izolován již dříve, ale nebyl identifikován). Zjištění, že se jedná o prvek (A. L. Lavoisier) znamenalo konec vlády flogistonové teorie a položilo základ moderní chemie. Název prvku (pocházející od A. L. Lavoisiera) byl navržen na základě mylné domněnky, že kyslík je determinujícím prvkem kyselin.
Kyslík je nejhojnějším biogenním prvkem na Zemi a tvoří obrovské množství sloučenin. Vyskytuje se volný i vázaný. Jeho celkový obsah v hydrosféře, litosféře a atmosféře je 45,5 %, obsah v atmosféře činí 21 obj. % (23 % hmotnostních, všechen organického původu) a v hydrosféře (i rozpuštěný) 85 %. Nejhojnějším prvkem je i na povrchu Měsíce (44,6 %). Přírodní kyslík je směsí tří izotopů 16 O (99,76 %), 17O (0,04 %) a 18O (0,2 %). Komerčně dostupné jsou preparáty obohacené 17O (mají využití v NMR spektroskopii) i 18O (významné pro vibrační spektroskopii). Radioaktivní izotopy existují, ale všechny mají krátké poločasy rozpadu (pro nejstálejší 15O je τ1/2 = 122 s). Kyslík má dvě alotropické formy - dikyslík O2 a ozon O3. V přírodě kyslík vzniká při fotosyntéze, kterou lze ve velmi hrubém zjednodušení popsat rovnicí
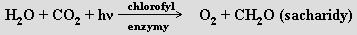
Jde o silně endotermický proces (ΔH0 = 469 kJ.mol-1), který probíhá přes mnoho meziproduktů a jemuž potřebnou energii dodává sluneční záření. Většinu energie člověk dodnes zí skává spalováním fosilních paliv, které jsou akumulátorem sluneční energie)Před 3 miliardami let zemská atmosféra žádný kyslík neobsahovala. Fotosyntéza začala před 2,5 miliardami let, po 500 milionech let bylo v atmosféře již významné množství kyslíku a během následující 1,5 miliardy let jeho obsah vzrostl na 5 %. Posledních padesát milionů let je obsah kyslíku v atmosféře prakticky konstantní. Recyklace dikyslíku v atmosféře trvá 2000 let, oxidu uhličitého 300 let (1,5.109 km3 vody v oceánech recykluje za dva miliony let).
Dikyslík O2 (b. t. -218,8 °C, b. v. -182,97 °C) je obtížně zkapalnitelný plyn bez barvy, chuti a zápachu. Kapalný a pevný je světlemodrý (modrá barva oblohy však není způsobena zbarvením silné vrstvy plynného kyslíku, ale Rayleighovým rozptylem světla), jsou známy tři jeho krystalové modifikace. Molekuly O2 jsou paramagnetické, přestože obsahují sudý počet elektronů. Ve vodě se kyslík rozpouští omezeně (v 1 litru vody 49 cm3 při 0 °C, 31 cm3 při 20 °C), v organických rozpouštědlech až 10× lépe (významné je proto odplynění rozpouštědel pro reakce, které mohou být přítomností volného kyslíku ovlivněny).
Kovalentní vazby uplatňuje kyslík ve sloučeninách s kovy i nekovy, jako elektropozitivní složka vystupuje vzhledem k vysoké elektronegativitě (3,5) pouze ve sloučeninách s fluorem. Může vytvořit až čtyři σ-vazby a uplatňovat i π-vazebnou interakci. Převážně iontový charakter mají vazby aniontů oxidového O2−, peroxidového O22− a hyperoxidového O2− s kationty nejelektropozitivnějších kovů. Kationt dioxygenylový O2+ je schopen existovat ve spojení s některými fluoroanionty (BF4−, PtF6−, PF6−) Koordinační číslo kyslíku může dosáhnout hodnoty osm (v oxidech M2 O s antifluoritovou strukturou; nejsou známy sloučeniny, v nichž by kyslík uplatňoval koordinační číslo sedm). Dikyslík může vystupovat i jako ligand v komplexech. Podle typu σ-vazebné interakce se rozlišují hyperoxo-, peroxo- (poměr M:O = 1:2) a můstkové komplexy (M:O = 1:1). Značný význam pro modelování přenosu kyslíku v organismech i při homogenní a heterogenní katalýze mají komplexy, v nichž je vázán reverzibilně (L. Vaska, 1963)
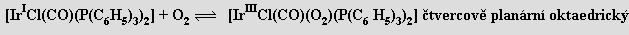
Základní tripletový stav molekuly O2 (dva nepárové elektrony) se energeticky liší poměrně málo od singletových stavů (1Δg, 1Σg+) bez nepárových elektronů. Kyslík v takové velmi reaktivní formě (singletový kyslík; využívá se v organické syntéze, důležitou roli hraje při fotodegradaci polymerů) lze připravit fotochemicky (H. Kautsky, 30. léta 20. století, znovu objeveno 1964)
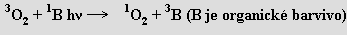
Fotochemickými procesy vzniká ve vyšších vrstvách atmosféry a tvoří se i při některých chemických reakcích
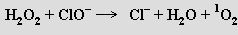
Kyslík je vysoce reaktivní prvek se silnými oxidačními vlastnosti. Jsou známy jeho sloučeniny se všemi prvky s výjimkou lehčích vzácných plynů, strukturně jsou značně variabilní a často mají charakter berthollidů. Přímo reaguje se všemi prvky s výjimkou halogenů, vzácných plynů a některých ušlechtilých kovů většinou exotermickými reakcemi (s organickými sloučeninami reaguje bez výjimky). Jsou-li spontánní oxidační reakce provázeny vznikem světla, nazývají se hoření.
Dikslík se připravuje elektrolýzou vody, termickým rozkladem oxidů, peroxidů a některých solí (rozkladu NaClO3 se využívá v kyslíkových svíčkách sloužících jako nouzový zdroj kyslíku k dýchání)
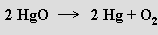
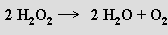
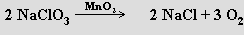
nebo reakcí některých vyšších oxidů s kyselinou sírovou:
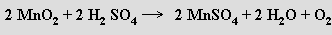
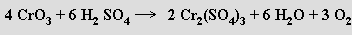
Velmi čistý kyslík lze připravit termickým rozkladem manganistanů
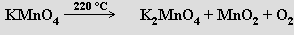
Průmyslově se vyrábí v obrovských množstvích (v roce 1995 byl v USA objemem výroby třetí chemický produkt po kyselině sírové a dusíku s 23.3 mil. tun) frakční destilací kapalného vzduchu (dusík s bodem varu -196 °C je těkavější než kyslík vroucí při -183 °C). Používá se při oxidačních procesech a spalování, v metalurgii k intenzifikace procesů (bessemerace), při řezání a svařování kovů, v lékařství, k pohonu raket (první stupeň Saturnu V obsahoval 1450 t kapalného kyslíku, který za 2,5 minuty zoxidoval 550 tun kerozinu, ve 2. stupni bylo 315 m3 a ve 3. stupni 76,3 m3 O2, jako palivo sloužil kapalný vodík) a k čištění odpadních vod.
Ozon O3 (b. t. -193 °C, b. v. -112 °C) je jedovatý, bezbarvý, v silnějších vrstvách modrý plyn nazvaný podle svého charakteristického zápachu (ozein = páchnouti; čichem je rozpoznatelný již v koncentraci 0,01 ppm, nejvyšší přípustné množství ve vzduchu pro člověka je 0,1 ppm). Kapalný ozon je tmavě modrý, pevný černofialový. Dobře se rozpouští ve vodě (494 cm3 v 1 litru vody). Délka vazeb v nelineárních molekulách O3 je rO-O = 127,8 pm (vazebný řád 1,5; srovnej s jednoduchou vazbou 149 pm a dvojnou 121 pm) a αOOO = 116,8°. Poměrně malá vzdálenost mezi terminálními kyslíkovými atomy (218 pm, součet poloměrů dvou atomů O je 280 pm) naznačuje, že i mezi nimi existuje vazebná interakce. K tvorbě σ-vazeb jsou na všech třech atomech kyslíku využity hybridy sp2, delokalizovaný π-systém se obvykle popisuje rezonančními strukturami.
Ozon je velmi reaktivní (při koncentraci nad 70 % explozívní) a má silné oxidační účinky v plynném stavu i v roztoku. V kyselých roztocích je výrazně stabilnější než v alkalických. Ozon se stanovuje jodometricky zaváděním do roztoku jodidu draselného v boritanovém pufru a titrací vyloučeného jodu thiosíranem sodným s použitím škrobu jako indikátoru
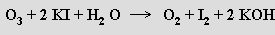
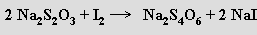
S alkalickými hydroxidy ozon reaguje za tvorby nestabilních ozonidů MO3. Krystalovou strukturou jsou ozonidy příbuzné azidům (to původně vedlo k nesprávnému závěru, že aniont O3− i molekula ozonu jsou lineární podobně jako N3−; pro aniont O3− se uvádí rO-O = 119 pm při vazebném řádu 1,25, což je kratší vzdálenost než v molekule O2 s vazebným řádem 2,0!).
Ozon se připravuje účinkem tichého elektrického výboje na vzdušný kyslík v Siemensově ozonizátoru konvertujícím 10 % dikyslíku na ozon. Reakce je silně endotermická (142 kJ.mol-1), zpětný rozklad je však bez přítomnosti katalyzátorů pomalý. Čistý ozon lze získat zkapalněním směsi (oba alotropy se v kapalném stavu nemísí) a odpařením dikyslíku. Vzniká také při elektrochemické oxidaci kyseliny sírové (vedle kyseliny peroxodisírové, pracuje-li se za nízkých teplot a s velkými proudovými hustotami) a při termickém rozkladu (130 °C) kyseliny hydrogenjodisté.
Ozon se používá na sterilizaci vody (pro tyto účely se v malých koncentracích vyrábí fotochemicky použitím UV záření), čištění vzduchu, bělení olejů a škrobu. V horních vrstvách atmosféry je filtrem ultrafialového záření. K jeho významnému úbytku v této dislokaci přispělo v posledních desetiletích masivní používání freonů (hnací media v rozprašovačích, náplně chladicích zařízení). Naopak v přízemních vrstvách atmosféry, kde je přítomnost ozonu nežádoucí, se jeho koncentrace zvyšuje v důsledku intenzivní lidské technologické činnosti.
Atomární kyslík O je extremně reaktivní a podobně jako atomární vodík ho nelze izolovat. V základním stavu (3P) se dvěma nepárovými elektrony vzniká fotolýzou dikyslíku, oxidu dusičitého nebo dusného v přítomnosti rtuti. Reaktivnější diamagnetickou singletovou formu (1D) lze připravit rovněž fotolyticky z ozonu nebo oxidu dusného bez přítomnosti rtuti. Jeho reakce mají často explozívní charakter nebo jsou provázeny chemiluminiscencí. Jako účinné oxidovadlo se uplatňuje i ve vyšších vrstvách atmosféry.