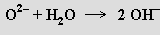
Jako oxidy se označují jen ty sloučeniny prvků s kyslíkem, v nichž je kyslík elektronegativnější složkou. Maximální oxidační stupeň prvku v oxidu obvykle odpovídá číslu skupiny (v krátké formě periodické tabulky), do níž prvek patří (charakteristický oxidační stupeň). Oxidy prvků krátkých period jsou bezbarvé, barevné jsou oxidy přechodných kovů a některých prvků dlouhých period. Podle typu vazby dělíme oxidy do tří skupin.
Iontové oxidy jsou pevné látky, jejichž mřížky tvoří anionty O2− a kationty kovu. Mají vysoké body tání, které se zvyšují s nábojem a snižováním objemu kationtu (bod tání je dán velikostí mřížkové energie, orientační odhad je možný posouzením rozsahu polarizace aniontu kationtem). Tvoří je alkalické kovy, kovy alkalických zemin, lanthanoidy, aktinoidy a některé přechodné kovy v nižších oxidačních stavech. Na vazbách je vždy významný podíl kovalence (v oxidu hořečnatém mají vazby jen 50 % iontového charakteru, v oxidu hlinitém, titaničitém a manganičitém je již převaha kovalence). Reagují-li s vodou, tvoří hydroxidy a nazývají se proto zásadotvornými oxidy
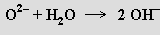
Ve vodě nerozpustné zásadotvorné oxidy reagují se zředěnými kyselinami za tvorby solí
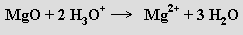
Podskupinou tohoto typu jsou podvojné oxidy obsahující dva druhy atomů kovu kombinované s atomy kyslíku do trojrozměrné struktury. Nejvýznamnější jsou tři typy podvojných oxidů. Struktura perowskitu ABO3 vzniká při kombinaci velkého atomu A a malého atomu B (CaTiO3, SrTiO3, BaCeO3, LaCrO3, KNbO3). Struktura ilmenitu ABO3 se tvoří, jsou-li atomy A i B malé. Je analogická struktuře korundu α-Al2O3 (atomy hliníku obsazují dvě třetiny oktaedrických mezer), v níž jsou atomy hliníku nahrazeny střídavě atomy A a B (FeTiO3 , MnTiO3, CoTiO3, NiTiO3). Struktura spinelu AB2O4 představuje kubickou plošně centrovanou mřížku atomů kyslíku, v jejichž tetraedrických dutinách jsou atomy A a v oktaedrických dutinách atomy B ( MgAl2O4 , MnAl2O4, FeAl2O4, CoAl2O4). V obrácených spinelech B(AB)O4 zaujímá polovina atomů B tetraedrické polohy, atomy A a druhá polovina atomů B oktaedrické pozice (FeIII (FeIIFeIII)O4).
V polymerních oxidech jsou atomy kyslíku a kovu spojeny polárními kovalentními vazbami do trojrozměrných, rovinných nebo řetězovitých útvarů. Tvoří je kovy s elektronegativitou vyšší než 1,5 ve vyšších oxidačních stupních, některé polokovy i nekovy. Vysoké body tání se pozorují především u trojrozměrných mřížek. Reagují-li s vodou za vzniku kyselin (oxid boritý, oxid seleničitý), nazývají se kyselinotvornými oxidy
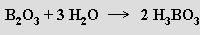
Některé oxidy této skupiny jsou zásadotvorné a reagují s kyselinami za tvorby solí
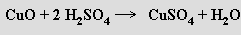
Zbývající mají amfoterní charakter a reagují se silnými kyselinami
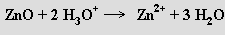
i zásadami
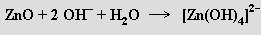
Molekulové oxidy tvoří většina nekovů (vodík, uhlík, dusík, fosfor, síra) a některé kovy v nejvyšších oxidačních stupních (MnVII, OsVIII). Snadno těkají a jsou typickými daltonidy. S vodou reaguje většina z nich za tvorby kyselin
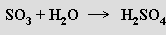
se zásadotvornými oxidy tvoří soli
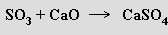
Některé z oxidů tohoto typu jsou vůči vodě indiferentní (oxid uhelnatý, oxid dusný) a nejsou proto prekurzory kyselin ani zásad.
Oxidy se připravují reakcemi prvků s kyslíkem při zvýšené teplotě, termickým rozkladem hydroxidů
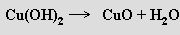
nebo některých kyslíkatých solí
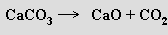

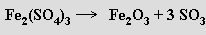
Používají se i reakce prvků s vodní párou při vysoké teplotě
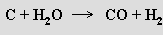
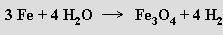
oxidace některých prvků kyselinou dusičnou (oxid sírový, oxid germaničitý, oxid cíničitý), termický rozklad nebo redukce vyšších oxidů vodíkem nebo oxidem uhelnatým (oxid manganatý, oxid železnatý, oxid molybdeničitý, oxid vanaditý).
Voda H2O je bezbarvá kapalina bez zápachu s mnoha výjimečnými fyzikálními i chemickými vlastnostmi. Anomální jsou změny hustoty kapalné vody v závislosti na teplotě, vysoký bod tání i varu v poměru k malé molekulové hmotnosti, vysoké hodnoty skupenských tepel tání a vypařování i měrné tepelné kapacity, velké povrchové napětí i prudký pokles viskozity s růstem teploty. Termicky je voda mimořádně stabilní, její body tání a varu jsou teplotními standardy. Led existuje v devíti polymorfních modifikacích, běžná forma (Ih) je hexagonální s poměrně prázdnou mřížkou umožňující vznik klathrátů. To způsobuje, že led má při 0 °C nižší hustotu než stejně teplá voda. Led existující při nízkém tlaku a teplotě -80 až -140 °C je kubický, amorfní led se tvoří kondenzací při teplotě nižší než -100 °C. I v kapalné vodě je zachována určitá uspořádanost (obvykle popisovaná oktaedrickým modelem), která s rostoucí teplotou postupně klesá.
Voda umožňuje životní procesy, má vliv na řadu geologických dějů. Je nejpoužívanějším rozpouštědlem, elektrolyticky ji lze rozložit na vodík a kyslík. Přírodní voda není nikdy zcela čistá (případ polyvody v 60. letech ukázal, že to může zásadním způsobem ovlivnit řadu jejich vlastností), vždy obsahuje rozpuštěné soli. Způsob čištění (destilace, pomocí ionexů nebo chemicky) závisí na účelu použití. Uplatňuje se jako součást struktury hydrátů (dislokace molekul vody ve vnější koordinační sféře) a aquakomplexů (voda je součást vnitřní koordinační sféry).
Součástí vody v přírodě je těžká voda D2O (b. t. 3,82, b. v. 101,42 °C, = 1,1053 g.cm-3 při 20 °C), jejíž chemická reaktivita i fyzikální vlastnosti se poněkud liší od H2O. Iontový součin D2O je ≈ 7× menší než u H2O a těžká voda je proto hůře ionizujícím rozpouštědlem. Těžká voda se používá jako moderátor rychlých neutronů v jaderných reaktorech a v chemickém výzkumu.
Peroxid vodíku H2O2 (připravil ho J. L. Thenard, 1818) je bezbarvá až světle modrá sirupovitá kapalina hustší než voda (1,44 g.cm-3) s bodem tání -0,89 °C. Uspořádání atomů v jeho molekule vystihuje vzorec HOOH (úhel OOH je 95°, diedrický úhel HOO/OOH 111°). Peroxid vodíku je nestálý, před dosažením bodu varu (152 °C, za laboratorní teploty je rozklad velmi pomalý) se explozívně rozkládá. Rozklad probíhá radikálovým mechanismem a urychlují ho jemně rozptýlené kovy a prach, naopak jako stabilizátor působí některé anorganické kyseliny a acetanilid. Je výborným polárním ionizujícím rozpouštědlem, v němž se vodíkové můstky uplatňují ve větší mí ře než ve vodě, s níž se neomezeně mísí. Má charakter slabé kyseliny (106× slabší baze než voda) a vytváří dvě řady solí. Peroxidy alkalických kovů a kovů alkalických zemin mají iontovou strukturu a připravují se spalováním kovu v kyslíku. Peroxid barnatý BaO2 vzniká při zahřívání (500 °C) oxidu barnatého v atmosféře kyslíku. Peroxidový anion je velmi silnou bazí
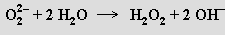
Hydrogenperoxidy známé u některých alkalických kovů
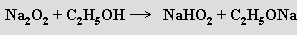
lze izolovat jen ve formě peroxohydrátů (NaHO2.1/2H2O2).
Peroxid vodíku je silným oxidovadlem v kyselém i zásaditém prostředí
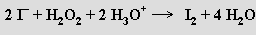
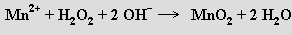
Vůči silným oxidovadlům může působit i redukčně, uvolňovaný kyslík pak pochází výlučně z H2O2 (oxidační činidlo pouze odejme oba elektrony z O22−)
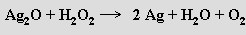
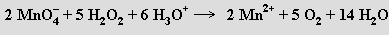
Organické peroxidy obsahující skupinu -OOH nebo můstek -O-O- mohou být příčinou explozí při destilaci organických rozpouštědel.
Průmyslově se ≈ 30% H2O2 vyrábí oxidací 2-ethylantrachinolu kyslíkem, vznikající chinon se katalyticky (katalyzátorem může být palladium nebo nikl) redukuje vodíkem na výchozí sloučeninu. 99% peroxid vodíku lze připravit frakční destilací nebo krystalizací.
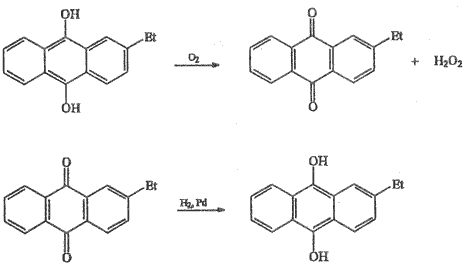
Dříve se v koncentraci 30–35 % získával hydrolýzou kyseliny peroxodisírové H2S2O8 připravené elektrolýzou 40% H2SO4
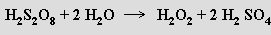
V laboratorním měřítku lze využít reakce peroxidu barnatého se zředěnou kyselinou sírovou
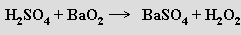
Peroxid vodíku se využívá jako bělicí prostředek v textilním, papírenském a potravinářském průmyslu. Široce se používá v chemickém průmyslu při výrobě anorganických (peroxouhličitany, peroxoboritany) i organických (epoxidy, propylenoxid, kaprolakton) sloučenin. Jeho oxidační schopnosti se často využívají i v chemických laboratořích. V domácnosti slouží k odbarvování vlasů a jako desinfekční prostředek.