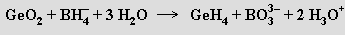
Germanium tvoří hydridy o složení Gen H2n+2 (n = 1 až 5). German GeH4 je plyn, který lze připravit redukcí oxidu germaničitého tetrahydroboratem sodným v kyselém prostředí
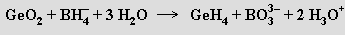
Působením halogenovodíků na german vznikají halogenogermany. Vyšší germany, které jsou překvapivě méně reaktivní než odpoví dající silany, se získávají účinkem elektrického výboje na GeH4. Cín tvoří stannan SnH4 a distannan Sn2 H6, olovo jen velmi nestálý plumban PbH4.
Žlutý oxid germanatý GeO vzniká při zahří váním oxidu germaničitého s kovovým germaniem na 1000 °C. Oxid cínatý SnO se připravuje termickým rozkladem šťavelanu cínatého
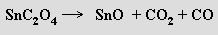
Červená (tetragonální) modifikace oxidu olovnatého PbO (klejt) vzniká oxidací roztaveného olova vzdušným kyslíkem.

[Zobrazit video]
| Pyroforické olovo |
Vysokoteplotní (stabilní nad 488 °C) žlutá (orthorombická) forma PbO (masikot)se připravuje se termickým rozkladem uhličitanu nebo dusičnanu olovnatého.
Oxid germaničitý GeO2 se strukturou i vlastnostmi podobá oxidu křemičitému. Oxid cíničitý SnO2 je ve formě kassiteritu s rutilovou strukturou hlavní cínovou rudou. Lze ho připravit pražením oxidu cínatého na vzduchu, zatímco pražením oxidu olovnatého vzniká oxid diolovnato-olovičitý Pb3O4 (minium, suřík), v jehož krystalech jsou hranami spojené řetězce oktaedrů PbIVO6 a mezi nimi trigonální pyramidy PbII O3. Pb3O4 reaguje s kyselinou dusičnou za tvorby oxidu olovičitého a dusičnanu olovnatého
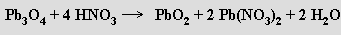
Oxid olovičitý PbO2 se připravuje oxidací olovnatanů chlornany

nebo elektrochemicky anodickou oxidací olova. Má rutilovou strukturu a je vysoce účinným oxidačním činidlem v kyselém i zásaditém prostředí
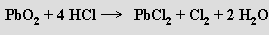
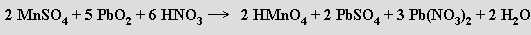
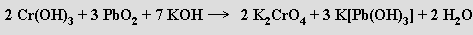
Germanium a cín tvoří sulfidy MS a MS2, olovo pouze sulfid olovnatý PbS. Připravují se přímou reakcí prvků za zvýšené teploty nebo srážením roztoků jejich rozpustných solí sulfánem.

[Zobrazit video]
| Příprava PbS |

[Zobrazit video]
| Příprava PbS II |
Sulfid cíničitý SnS2 se rozpouští v roztocích sulfidů alkalických kovů za tvorby trithiocíničitanů
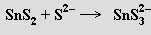
Ze sulfidu cínatého SnS lze získat stejný produkt reakcí s disulfidem alkalického kovu
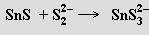
Halogenidy MX2 jsou málo těkavé látky s převažujícím iontovým charakterem vazeb, jejichž stabilita roste od germania k olovu. Fluorid GeF2 a chlorid germanatý GeCl2 se připravují za zvýšené teploty z GeX4 a germania. Fluorid cínatý SnF2 (používá se v zubních pastách), který tvoří cyklické tetramery, reaguje v roztoku s nadbytkem fluoridových inotů za vzniku trifluorocínatanůSnF3−, které při zahušťování roztoku kondenzují na Sn2F5−. Chlorid cínatý SnCl2 má vrstevnatou strukturu (v parách je monomerní), je Lewisovým amfolytem a v roztoku se rychle hydrolyzuje
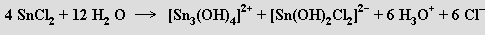
V kyselině chlorovodíkové se rozpouštějí za tvorby trifluorocínatanů SnCl3− se silnými redukčními schopnostmi
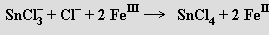

[Zobrazit video]
| Reakce kovového cínu s bromem za vzniku bromidu cínatého |
Halogenidy olovnaté PbX2 jsou málo rozpustné krystalické látky (v chloridu a bromidu uplatňuje olovo koordinační číslo devět ve složité struktuře).
Snadno se hydrolýzující kapalné chloridy germaničitý GeCl4 a cíničitý SnCl4 se tvoří reakcí prvků. Rovněž kapalný chlorid olovičitý PbCl4, který vzniká reakcí oxidu olovičitého s koncentrovanou kyselinou chlorovodíkovou, je nestálý a rozkládá se na chlorid olovnatý a chlor (stabilita se zvyšuje další koordinací, hexachloroolovičitany MI2[PbCl6] jsou stabilní žluté pevné látky). Bromid olovičitý PbBr4 je vzhledem k oxidačním schopnostem PbIV značně labilní, existence jodidu olovičitého PbI4 nebyla jednoznačně prokázána.
Nestálý žlutý hydroxid germanatý Ge(OH)2 lze připravit hydrolýzou halogenidů GeX2. Hydroxidy cínatý Sn(OH)2 a olovnatý Pb(OH)2 vznikají srážením roztoků příslušných solí alkalickými hydroxidy. Jsou amfoterní, mají proměnlivé složení, a je proto lépe je považovat za hydratované oxidy MO.xH2O (M = Sn, Pb). V kyselinách se rozpouštějí na soli cínaté a olovnaté, s alkalickými hydroxidy tvoří komplexní hydroxoanionty.
Oxidy MO2 lze tavením s hydroxidy alkalických kovů převést na rozpustné germaničitany, cíničitany a olovičitany. Jsou známy meta- (GeO32−) a ortho-germaničitany (GeO44−, v obou typech aniontů má germanium koordinační číslo čtyři). Cíničitany a olovičitany obsahují oktaedrické anionty [M(OH)6]2− (M = Sn, Pb). Okyselením roztoků cíničitanů se sráží hydratovaný oxid cíničitý SnO2.xH2 O (kyselina α-cíničitá, která stáním v horkém roztoku přechází na méně reaktivní kyselinu β-cíničitou). Reakcí SnO2.xH2O s kyselinou chlorovodíkovou vznikají hexachlorocíničitany [SnCl6]2−
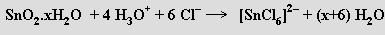
působením hydroxidů se tvoří hexahydroxocíničitany [Sn(OH)6]2-
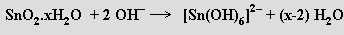
Chroman PbCrO4 (chromová žluť) a hydroxidouhličitan olovnatý Pb(OH)2.2PbCO3 (olověná běloba) se využívaly jako pigmenty. Octan olovnatý [Pb(CH3COO)2] je ve vodě rozpustný, ale málo ionizovaný. Jeho přídavkem lze málo rozpustné olovnaté soli převést do roztoku jako acetátové komplexy [Pb(CH3COO)3]− a [Pb(CH3 COO)4]2−. Octan olovičitý Pb(CH3COO)4 (s koordinačním číslem olova osm) je silné oxidační činidlo používané v organické syntéze a v analytické chemii.
Až na výjimky se chemie organokovových sloučenin germania, cínu a olova týká jen prvků v oxidačním stavu +IV. Tepelná stálost těchto sloučenin i energie vazeb M-C klesá s rostoucím atomovým číslem prvku M. Organogermaniové sloučeniny jsou poněkud méně stabilní než organokřemičité, především v důsledku nižší energie vazeb Ge-Ge. Roli hraje i menší sklon k tvorbě násobných vazeb s uhlí kem, dusíkem a kyslíkem. Organokovové sloučeniny cínu typu RnSnIVX4-n (R = alkyl nebo aryl, X = halogen) se uplatňují jako stabilizátory plastů z PVC, vytvrzovací činidla při vulkanizaci silikonů a v zemědělství jako biocidy (ničí houby, plísně, roztoče, hmyz při minimální toxicitě pro vyšší živočichy). Z více než dvou tisíc známých organoolovnatých sloučenin má stále ještě nejrozsáhlejší použití tetraethylplumban PbEt4 jako antidetonační přísada do benzinu. Jednou z mála komplexních sloučenin olova v oxidačním stavu +II je [Pb(η5-C5H5)2] s neparalelními kruhy svírajícími úhel 135° a s neobvyklou řetězovitou strukturou (na jejím vzniku se podílí interakce volného elektronového páru atomu olova se sousedním cyklopentadienylovým kruhem).