
Selan H2Se (b. t. -60,4 °C, b. v. -41,5 °C) a tellan H2Te (b. t. -51 °C, b. v. -1.8 °C) jsou bezbarvé jedovaté plyny s charakteristickým zápachem. Strukturně jsou jejich molekuly analogické sulfánu. Jsou to nestálé endotermické sloučeniny snadno podléhající oxidaci na dioxidy. Vznikají rozkladem selenidů a telluridů kyselinami, syntézou z prvků lze připravit pouze selan. Vodné roztoky selanu (pKa≈ 4) a tellanu (pKa≈ 3) jsou silnějšími kyselinami než kyselina sirovodíková. Soli MI2Y (Y = Se, Te) a MIHSe jsou ve vodě rozpustné jen tehdy, jde-li o soli alkalických kovů. Stabilita polychalkogenidů MI2Yx (Y = Se, Te) se s rostoucí atomovou hmotností chalkogenu snižuje.
Oxid seleničitý (SeO2)n je řetězovitý polymer, který lze roztavit pouze pod tlakem (sublimuje při 315 °C). Je dobře rozpustný ve vodě, s níž poskytuje kyselinu seleničitou H2SeO3. Laboratorně ho lze snadno získat rozpuštěním selenu v koncentrované kyselině dusičné a následnou termickou dehydratací primárně vznikající kyseliny seleničité. Používá se jako mírné oxidační činidlo v organické syntéze. Oxid telluričitý TeO2 je výrazně méně těkavý (b. t. 733 °C) než oxid seleničitý. Ve vodě je nerozpustný, rozpouští se v hydroxidech za vzniku telluričitanů i v silných kyselinách za tvorby sloučenin typu Te2O3SO4. Připravit ho lze reakcí prvků nebo dehydratací kyseliny telluričité. Existuje ve dvou krystalografických modifikacích analogických rutilu a brookitu.
Oxid selenový (SeO3)n je silně hygroskopická bílá krystalická látka známá ve dvou polymorfních modifikacích, z nichž stabilní je tvořena cyklickými tetramerními molekulami (SeO3)4 a nestabilní trimerními molekulami (SeO3)3. Stejné částice existují i v kapalném a plynném stavu a v nevodných roztocích. Tendence k disociaci na monomerní jednotky SeO3 je proti oxidu sírovému zanedbatelná. Oxid selenový je termodynamicky méně stabilní než oxid seleničitý, a proto se jeho přípravu v čistém stavu nedařilo dlouho realizovat. Nejvýhodněji ho lze získat dehydratací bezvodé kyseliny selenové oxidem fosforečným a vakuovým vysublimováním z reakční směsi (K. Dostál, 1951). Oxid tellurový TeO3 je oranžová pevná látka s trojrozměrnou mřížkou složenou z oktaedrů TeO6 spojených navzájem s využitím všech šesti vrcholů. Je znám ve dvou polymorfních modifikacích, s vodou nereaguje, při vyšších teplotách se chová jako silné oxidační činidlo. Připravuje se dehydratací kyseliny hexahydrogentellurové H6TeO6.
Nižší fluoridy (FSeSeF, Se=SeF2 a SeF2) a chloridy (ClSeSeCl a SeCl2) selenu jsou strukturními ekvivalenty odpovídajících sloučenin síry a u telluru nejsou známy. Tellur tvoří strukturně i stechiometricky neobvyklý chlorid Te3Cl2 s charakterem řetězovitého polymeru. Existuje několik nižších binárních sloučenin jodu s tellurem (Te2I, Te4I4), ale žádná se selenem.
Jsou známy všechny tetrahalogenidy selenu a telluru s výjimkou jodidu seleničitého. Zatímco fluorid seleničitý SeF4 je strukturně analogický monomernímu fluoridu siřičitému, fluorid telluričitý TeF4 má charakter řetězového polymeru. Oba se získají řízenou fluorací příslušného chalkogenu. Od tetrafluoridů se odvozují poměrně stálé pentafluoroseleničitany a pentafluorotelluričitany. Pevné tetrachloridy YCl4 (Y = Se, Te; nejvyšší chloridy obou prvků) vznikají působením nadbytku chloru na chalkogen. Chloridy seleničitý SeCl4 a telluričitý TeCl4 tvoří tetramerní krychlové útvary Y4Cl16 (Y = Se, Te; stejnou strukturu mají i bromidy seleničitý SeBr4 a telluričitý TeBr4 a jodid telluričitý TeI4) a (podobně jako SCl4) s vhodnými anionty poskytují soli kationtů SeCl3+ a TeCl33. V přítomnosti nadbytku halogenidů alkalických kovů tvoří tetrahalogenidy YX4 (Y = Se, Te; X = Cl, Br) hexahalogenoanionty YX62−, v nichž volný elektronový pár na atomu chalkogenu není stereochemicky aktivní. Plynné hexafluoridy YF6 (Y = Se, Te) se tvoří působením nadbytku fluoru na příslušný chalkogen. Připraveny byly i smíšené halogenidy TeClF5 a TeBrF5. Dekafluoridy Se2F10 a Te2F10 nejsou známy (produkt původně deklarovaný jako Te2F10 se ukázal být O(TeF5)2; existuje i jeho selenový analog O(SeF5)2).
Kyselina seleničitá H2SeO3 je bezbarvá krystalická látka, která se připravuje oxidací selenu kyselinou dusičnou. Lze ji snadno dehydratovat na oxid seleničitý. Její vodný roztok působí, na rozdíl od roztoků oxidu siřičitého, častěji oxidačně než redukčně

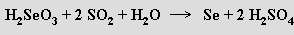
Jsou známy i diseleničitany MI2Se2O5, které, na rozdíl od disiřičitanů, mají symetrické anionty O2SeOSeO22− s můstkovým atomem kyslíku spojujícím oba atomy selenu. Reakcí roztoku kyseliny seleničité se sírou se tvoří thioselenany MI2SeO3S, známy jsou i s nimi izomerní selenosírany MI2SO3Se. Kyselina telluričitá H2TeO3 existuje jen v roztoku, při jeho zahušťování postupně polymeruje a vylučuje se oxid telluričitý. Nejčastěji se připravuje reakcí chloridu telluričitého s vodou.
Nejdůležitějšími halogenoderiváty kyseliny seleničité jsou difluorid seleninylu SeOF2 (agresivní látka korodující sklo) a dichlorid seleninylu SeOCl2, který se využívá jako rozpouštědlo s vysokou permitivitou.
Kyselina selenová H2 SeO4 (b. t. 57 °C) je pevná krystalická látka s výrazným sklonem k tvorbě podchlazené taveniny. Připravuje se reakcí selenanu barnatého s kyselinou sírovou nebo ze selenanu hořečnatého na ionexech. Má silnější oxidační účinky než kyselina sírová (s výjimkou fluoridů oxiduje halogenidy na volné halogeny). Kromě stříbra rozpouští i zlato a palladium a v přítomnosti aniontů chloridových i platinu. Je silnou kyselinu tvořící dvě řady solí. Z halogenoderivátů kyseliny selenové jsou známy pouze kyselina fluoroselenová HSeO3F a difluorid selenonylu SeO2F2, které jsou vlastnostmi a strukturou blízce příbuzné analogickým derivátům kyseliny sírové. Kyselina chlorselenová HSeO3F je schopná existence pouze za teploty nižší než -10 °C.
Kyselina hexahydrogentellurová (orthotellurová) H6TeO6 (b. t. 136 °C) je krystalická látka, která se připravuje oxidací telluru roztokem kyseliny chlorečné
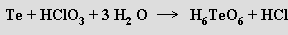
Je známa i ve formě tetrahydrátu. Molekuly Te(OH)6 mají (i v roztoku) tvar pravidelných oktaedrů a v tomto směru se tellur více podobá svým horizontálním sousedům (cínu, antimonu a jodu) než síře a selenu. Kyselina orthotellurová je poměrně silným oxidačním činidlem, ale velmi slabou kyselinou reagující s alkalickými hydroxidy za tvorby tetrahydrogentelluranů MI2H4TeO6, které lze termicky převést na tetraoxotellurany (metatellurany) MI2TeO4. Normální soli kyseliny orthotellurové MI6TeO6 lze připravit tavením metatelluranů s oxidem alkalického kovu. Kyselinu dihydrogentellurovou (polymetatellurovou) (H2 TeO4)n lze získat parciální termickou dehydratací (160 °C) kyseliny orthotellurové.
Extrémně explozívní tetranitrid tetraselenu Se4N4 má stejnou molekulovou strukturu jako tetranitrid tetrasíry. Rovněž explozívní nitrid telluru s dosud neznámou strukturou má složení spíše Te3N4 než Te4 N4.
Polykationty jsou, podobně jako u síry, známy i u selenu (Se42+,Se82+, Se102+) a telluru (Te42+, Te46+>) včetně smíšených ((TenSe4-n)2+, n = 1 - 4). Existují i kationty obsahující oba tyto prvky((TenSe4-n)2+, n = 1-4).
V poměrně rozsáhlé chemii organoprvkových sloučenin selenu (RSeH, R2Se, R2Se2, R2SeX2, R2SeO2; R = alkyl, aryl, X = halogen) jsou klíčovými výchozími sloučeninami selenidy a diselenidy. Analogické sloučeniny telluru jsou reaktivnější (a tedy méně stálé).