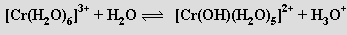
Chrom tvoří s kyslíkem oxidy chromový, chromičitý a chromitý. Přídavkem koncentrované kyseliny sírové do koncentrovaného roztoku alkalického dichromanu se vyloučí jehličkovité krystaly oxidu chromového CrO3 (nesprávně bývá označován jako „kyselina chromová“), tvořené řetězci vrcholy spojených tetraedrů CrO4.
Jeho termický rozklad (≈ 250 °C) vede přes řadu meziproduktů k oxidu chromitému.
Oxid chromičitý CrO2 (hnědočerný, krystaluje v rutilové mřížce) je jedním z meziproduktů redukce oxidu chromového. Je antiferromagnetický a jeho elektrická vodivost je na úrovni kovů. Používá se k výrobě magnetických záznamových pásků (ve srovnání s pásky s vrstvami z oxidu železitého mají lepší rozlišení i vysokofrekvenční charakteristiku).
Oxid chromitý Cr2O3 se vyrábí dehydratací své hydratované formy nebo redukcí alkalických chromanů uhlíkem. Nejobvyklejší způsob jeho laboratorní pří pravy je termický rozklad dichromanu amonného (získá se tak v nepříliš reaktivní formě, kterou lze jen obtížně převést do roztoku působením kyseliny chlorovodíkové)
nebo redukce alkalického dichromanu sírou
Je nejstálejším oxidem chromu a pod názvem chromová zeleň se používá jako pigment při výrobě vodových barev a nátěrových hmot.
Sulfidy jsou do značné míry podobné oxidům, stabilita se však posunuje k nižším oxidačním stavům (CrS3 není znám). Analogicky jako u oxidů existuje řada nestechiometrických sulfidických fází s kovovým nebo polovodivým charakterem a velmi rozmanitými magnetickými vlastnosti (dia-, para-, antiferro-, ferri- i ferromagnetismus). Selenidy a telluridy jsou sulfidům blízce příbuzné.
V halogenidech dosahuje chrom oxidačního stavu +VI pouze ve spojení s fluorem. Lze je připravit přímou syntézou z prvků, snadno se hydrolyzují, mají oxidační účinky a monomerní strukturu. V oxidačním stavu +IV je známa kompletní řada halogenidů (často se však dají pouze prokázat v plynné fázi za vysokých teplot, nejstálejší je tetrafluorid). Jejich přípravu lze realizovat redukcí vyšších (v případě fluoridů) nebo halogenací nižších halogenidů, využitelná je i kontrolovaná syntéza z prvků.
Také v oxidačních stavech +III a +II existují všechny halogenidy chromu. Fluorid chromitý CrF3 (zelený) se nejsnáze získává působením kyseliny fluorovodíkové na chlorid chromitý. Chlorid chromitý CrCl3 (červenofialový) vzniká přímou reakcí prvků, dehydratací svého hexahydrátu chloridem thionylu
zahříváním oxidu chromitého s chloridem uhličitým
nebo reakcí oxidu chromitého s uhlíkem v proudu chloru
Má vrstevnatou strukturu s oktaedrickou koordinací kovu (kubická plošně centrovaná mřížka Cl−, kationty CrIII obsazují 2/3 oktaedrických dutin). Bezvodý chlorid chromitý je ve vodě prakticky nerozpustný a rozpouští se až přídavkem stopového množství redukčního činidla. Z roztoku, v němž existují v rovnováze kationty [CrCl2(H2O)4]+ a [CrCl(H2O)5]2+ a [Cr(H2O)6]3+, krystaluje jako tmavozelený dihydrát chloridu tetraaquachromitého [CrCl2(H2O)4]Cl.2H2O (tmavozelený), který je jedním z izomerů hexahydrátu chloridu chromitého.
Bezvodé halogenidy chromnaté se připravují reakcí chromu s plynnými halogenovodíky (pouze k přípravě jodidu chromnatého se využívá reakce s elementárním jodem). Termická dehydratace hydrátů k tomuto cíli nevede, protože při ní probíhá hydrolýza. V kyselých roztocích se halogenidy chromnaté připravují redukcí sloučenin chromitých zinkem (je možno použít i rozpouštění práškového chromu v halogenovodíkových kyselinách)
Vznikají tak modré roztoky halogenidů hexaaquachromnatých [Cr(H2O)6]X2, které lze izolovat i v krystalickém stavu.
Za laboratorní teploty vzniká hydrolýzou kationtu hexaaquachromitého [Cr(H2O)6]3+ zpravidla jen kationt hydroxopentaaquachromitý
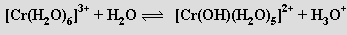
Postupným přidáváním hydroxidu k roztoku obsahujícímu kationty [Cr(H2O)6]3+ se odstraňují protony z koordinovaných molekul vody, až vznikne hydratovaný oxid chromitý („komplex trihydroxotriaquachromitý“) [Cr(OH)3(H2O)3]
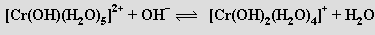
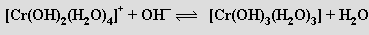
Hydratovaný oxid chromitý je amfoterní a rozpouští se v kyselinách na soli chromité
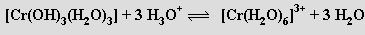
a v nadbytku hydroxidu na zelený roztok diaquatetrahydroxochromitanu
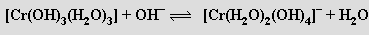
Kation [Cr(H2O)6]3+ je také složkou jen za chladu stálého fialového kamence chromitodraselného KCr(SO4)2.12H2O. Zahřátím v roztoku se zbarvuje zeleně v důsledku hydrolýzy a tvorby polyjaderných chromitých komplexů.
Mezi nejstálejší chromnaté soli patří diamagnetický dimer monohydrátu octanu chromnatého (Cr(ac)2.H2O)2, v němž existují vazby Cr-Cr.
Kyselina dichromová H2Cr2O7 vzniká rozpuštěním oxidu chromového ve vodě a z roztoku ji nelze izolovat
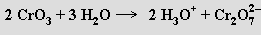
Rozpuštěním oxidu chromového v roztoku alkalického hydroxidu se tvoří žluté chromany MI2CrO4
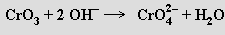
Průmyslově se vyrábějí pražením oxidu chromitého s alkalickými uhličitany na vzduchu
Jsou stálé jen v alkalickém prostředí, v kyselém přecházejí na oranžové dichromany MI2Cr2O7 (při pH 2 až 6 jsou v rovnováze ionty HCrO4− a Cr2O72−); dichroman sodný Na2Cr2O7 je technicky nejdůležitější sloučeninou chromu).
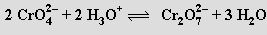
V koncentrovaných silně kyselých roztocích existují i tri- a tetrachromany. Chromany mají podstatně slabší oxidační účinky než dichromany, alkalické (a amonné) soli obou kationtů jsou ve vodě dobře rozpustné. Ve vodě nerozpustný chroman olovnatý PbCrO4 se používá jako pigment pod názvem chromová žluť.
Oxidačních vlastností aniontu dichromanového se využívá v odměrné analýze (chromátometrie), nejčastěji ke stanovení sloučenin železnatých
Okyselený roztok dichromanu draselného tvoří s peroxidem vodíku modrý peroxokomplex oxodiperoxochromanový [CrVIO(O2)2] extrahovatelný do diethyletheru, který s Lewisovými bazemi poskytuje adukty ([CrO5.py]).