Železo sehrálo dominantní roli ve vývoji materiálů používaných člověkem. Prvními, komu se podařilo získat železo z jeho rud tavením, byli Chetité, kteří objev pečlivě tajili (předtím bylo známo jen železo meteoritického původu). Teprve rozpadem jejich říše se technologie mohla rozšířit a před 3 200 lety začala doba železná. Sloučeniny kobaltu jsou už 4 500 let využívány k barvení skla a keramiky na modro a v Číně byly nalezeny předměty starší než 2 000 let zhotovené ze slitin niklu. V nečisté formě byly oba kovy připraveny v polovině 18. století (kobalt 1735, G. Brandt; nikl 1751, A. F. Cronstedt). Železo a kobalt mají nezastupitelné místo v biosystémech.
Železo je (po kyslíku, křemíku a hliníku) čtvrtým nejrozšířenějším prvkem v zemské kůře (6,2 %). Vzhledem ke stabilitě jeho jader je značně rozšířeno i ve vesmíru (zjištěnému obsahu 0,5 % železa v měsíčním prachu odpovídá množství 1012 tun tohoto kovu na povrchu Měsíce). Kobalt (29 ppm) je nejvzácnější z prvků první přechodné řady, nikl (99 ppm) je sedmý nejrozšířenější přechodný kov. Železo se (s výjimkou meteoritického) vyskytuje pouze ve sloučeninách, především oxidech, oxid-hydroxidech, uhličitanech a sulfidech. Jeho nejrozšířenějšími minerály jsou hematit (krevel) Fe2O3, magnetit Fe3O4, siderit (ocelek) FeCO3, limonit (hnědel) FeO(OH) a pyrit FeS2. V současné době se těžba omezuje jen na rudy s nejvyšším obsahem kovu (největší současné naleziště hematitu s obsahem 70 % Fe je v Austrálii). Kobalt a nikl se vyskytují často společně vázané se sírou nebo arsenem (smaltin CoAs2, kobaltin CoAsS, nikelin NiAs, gersdorfit NiAsS), nikl se vzácně nachází i ryzí.
Železo je neušlechtilý, měkký a kujný kov, který existuje ve třech alotropických modifikacích. α-železo (BCP) je stálé do 906 °C, γ-železo (CCP) do 1401 °C a δ-železo (CCP) nad touto teplotou. Železo je ferromagnetické do 768 °C (Curiův bod), a v teplotním intervalu 768 až 906 °C se proto označuje jako β-železo, i když jeho struktura se od α-modifikace neliší. Také kobalt a nikl jsou stříbrolesklé kovy (kobalt s modrým nádechem) s dobrými mechanickými vlastnostmi, za laboratorní teploty ferromagnetické (kobalt má Curieho bod při 1106 °C, nikl při 363 °C). Kobalt je tvrdší a pevnější než železo.
Běžnými oxidačními stupni všech tří prvků jsou +II a +III (méně často se vyskytují -II, 0, +I, +IV a u železa i +VI). V oxidačních stavech II a III má železo elektronovou konfiguraci d6 resp. d5. Převážná většina jeho sloučenin je proto silně paramagnetická (jen ligandy vytvářející velmi silná pole (např. kyanidy) mohou být příčinou nízkospinového uspořádání) a vazby v nich mají poměrně nízký stupeň iontovosti (u FeIII méně než u FeII). Nejčastějšími koordinačními čísly jsou šest ([Fe(H2O)6]2+, [Fe(CN)6]4−, Fe2O3) a čtyři (FeCl42−, Fe3O4), výjimečně i pět a sedm. Pásy přenosu náboje u komplexů FeIII zasahují až do viditelné oblasti spektra a překrývají absorpční pásy d-d-přechodů. Sendvičové komplexy typu ferrocenu [Fe(C5H5)2] jsou zajímavé především z hlediska teoretického popisu vazebných poměrů. Amoniak je řídkým ligandem v komplexech železa, ale velmi častým u kobaltu a niklu. Převážná většina ligandů stabilizuje NiII a CoIII, jednoduché sloučeniny kobaltité jsou naopak vzácné (kationt hexaaquakobaltitý [CoIII (H2O)6]3+ má v neutrálních a alkalických roztocích silné oxidační účinky a s vodou reaguje za vývoje kyslíku). Ve sloučeninách kobaltu a niklu převažuje oktaedrická koordinace, tetraedrická a čtvercově planární jsou méně časté.
Železo je reaktivní prvek, v jemně práškovité formě je pyroforické. Při vyšších teplotách reaguje s mnoha kovy i nekovy (síra, fosfor, chlor, uhlík). S dusíkem tvoří dva intersticiální nitridy (Fe2N a Fe4N), s kyslíkem tři oxidy (FeO, Fe2O3 a Fe3O4) s blízce příbuznými krystalovými strukturami a charakterem berthollidů. Železo se snadno se rozpouští ve zředěných kyselinách, hydroxidy na něj nepůsobí. Vážným technickým a ekonomickým problémem je koroze (rezavění) železavystaveného púsobení vlhkého vzduchu spojená s tvorbou oxidu železitého
V podstatě jde o rozpouštění železa ve vodě za uvolnění vodíku
a následnou oxidaci vodíku a kationtu železnatého dikyslíkem. Z elektrochemického hlediska je koroze podmíněna vznikem lokálních galvanických článků. Rezavění urychluje snížení pH a přítomnost oxidu uhličitého. Možnou ochranou proti korozi jsou nátěry, pokovení povrchu ušlechtilejšími kovy, fosfátování nebo pasivace vytvořením vrstvičky oxidu ponořením do kyseliny dusičné. Kobalt a nikl jsou ve srovnání se železem méně reaktivní, na vlhkém vzduchu nekorodují, přestože rovněž patří mezi neušlechtilé kovy. Jemně práškovité kovy jsou pyroforické, rozpouštějí se v anorganických kyselinách. S kyslíkem reagují při vyšších teplotách na oxidy a přímé reakce jsou známy i s dalšími nekovy (halogeny, síra, uhlík). V kyselině dusičné se pasivují. Nikl s fluorem reaguje obtížněji než jakýkoliv jiný kov a odolává i působení alkalických hydroxidů.
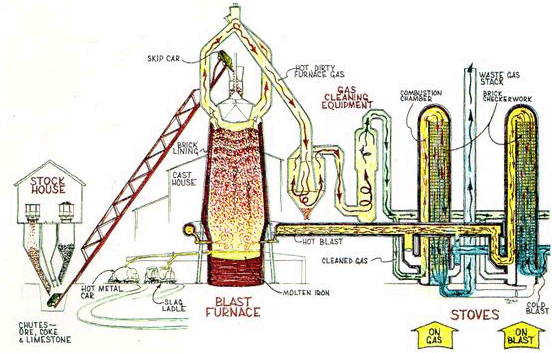
Železo lze připravit redukcí jeho oxidů vodíkem nebo elektrolýzou roztoků železnatých solí. V praxi je ekonomicky nejvýznamnější vysokopecní hutnický způsob využívající redukce kyslíkatých rud uhlíkem, i když čistota získaného kovu není vysoká.

Surové železo obsahuje 2 až 10 % příměsí (uhlík, síru, fosfor, mangan). Šedá litina obsahuje uhlík ve formě grafitu, bílá ve formě karbidu Fe3C. Litina obsahuje ≈ 1,7 % uhlíku, ocel méně než 1,7 %. Při obsahu uhlíku pod 0,2 % se hovoří o kujném železe. Zkujňování železa snižováním obsahu uhlíku jeho spalováním v proudu vzduchu nebo kyslíku je spojeno i s odstraněním dalších nežádoucích příměsí. Provádí se bessemerací (1856), Siemens-Martinovým (1860) nebo zásaditým kyslíkovým konvertorovým (1952) procesem. Ve všech postupech hraje důležitou roli vyzdívka konvertorů, s níž nečistoty zreagují a odstraní se v podobě strusky. Tvrdost a kujnost získaného kovu se mimo regulace obsahu uhlíku ovlivňuje i následným termickým zpracováním (kalení, temperování). Vysoce čisté železo se získá termickým rozkladem pentakarbonylu [Fe(CO)5]. Hutnická příprava kobaltu a niklu je obtížný proces, který je třeba vždy modifikovat podle použitých surovin. Rafinace se provádí elektrochemicky. Vysoce čistý nikl se získává reakcí surového kovu s oxidem uhelnatým při 80 °C a následným termickým rozkladem vzniklého tetrakarbonylu [Ni(CO)4] při 180 °C (Mondova metoda).
Vzhledem k rozsahu použití je železo základním kovem současné civilizace. Kobalt a nikl se používají převážně k výrobě speciálních ocelí s vysokou mechanickou i chemickou odolností. Kobalt je vhodným materiálem na výrobu permanentních magnetů, nikl slouží k povrchové ochraně železných výrobků, k výrobě Monelova kovu a jeho katalytické účinky se využívají při hydrogenačních reakcích (ztužování tuků).