Přibližně třicet prvků , z toho čtyři polokovy (bor, křemík, fosfor, selen) a deset nekovů, je významných pro život na Zemi. Sedm kovů je nezbytných pro všechny životní formy, nejdůležitější z nich jsou železo, zinek, hořčík, měď a draslík. Tvoří významnou složku metaloenzymů (vážou kov stabilně, nejen při vlastním procesu) a metaloproteinů (jak respiračních zajišťujících přenos kyslíku a oxidu uhličitého, tak i těch, které zprostředkovávají přenos elektronů).
Železo je nejdůležitějším přechodným kovem, který se účastní procesů v živých organismech. Bylo prvním kovem, u něhož byl poznán význam pro funkci lidského organismu (T. Sydeham v roce 1681 doporučoval k léčbě anémie železo ponořené do studeného rýnského vína). V těle dospělého člověka je obsaženo 4 až 6 g železa (0,005 % jeho hmotnosti, denní spotřeba činí pouze 1 mg), z nichž 75 % připadá na hemoglobin a 25 % je obsaženo v zásobních bílkovinách, takže aktuální potřeba nemusí být kryta okamžitým příjmem. Bílkoviny obsahující železo se účastní především transportu a skladování kyslíku a přenosů elektronů (jsou složkami nitrogenáz, oxidáz, reduktáz, dehydrogenáz a deoxygenáz). Dělí se na dvě skupiny podle toho, zda obsahují porfyrinový komplex železa nazývaný hem (hemoglobin, myoglobin, cytochromy) či nikoliv (transferrin, ferritin, ferredoxiny a bílkoviny MoFe a Fe). V hemu je železo obklopeno tetragonální pyramidou pěti atomů dusíku, z nichž čtyři jsou součástí rigidní plošné molekuly označované PIX (protoporfyrin IX) a pátý pochází z imidazolového cyklu v histidinu, který je jednou ze stavebních jednotek globinu.
Myoglobin tvořený polypeptidovými řetězci (globin má 150-160 jednotek aminokyselin, jeho molekulová hmotnost je přibližně 17000) obsahuje jednu hemovou skupinu a váže v buňkách kyslík před jeho upotřebením. Vyšší afinita myoglobinu ke kyslíku při nižších parciálních tlacích umožňuje převzetí molekuly dikyslíku z oxyhemoglobinu. Tento proces je podporován i snížením pH, které způsobuje při svalové činnosti vznikající oxid uhličitý.
Hemoglobin je obsažen v červených krvinkách (je příčinou jejich červeného zbarvení) a zajišťuje transport kyslíku tepennou krví z plic do svalů, kde ho předává imobilnímu myoglobinu. V tomto stadiu může být kyslík využit k uvolnění energie metabolickou oxidací glukózy, jejímž odpadním produktem je oxid uhličitý. Ten je pak opět pomocí hemoglobinu přenášen žilním systémem zpět do plic.

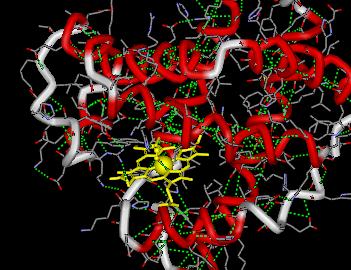
Železo je v deoxyhemoglobinu (hemoglobin bez koordinované molekuly dikyslíku) obsaženo jako vysokospinové FeII a reverzibilní koordinací dikyslíku (s tupým úhlem Fe-O-O) za vzniku oxyhemoglobinu přechází na nízkospinovou formu téhož oxidačního stavu. Hemoglobin je tvořen čtyřmi přibližně tetraedricky uspořádanými subjednotkami dvou typů (α- a β) podobnými myoglobinu, které jsou drženy pohromadě vzájemným elektrostatickým působením skupin -NH3+ a −OOC-.
V cytochromech je koordinace železa zcela analogická jako v hemoglobinu. Jejich základní funkcí však je přenos elektronů (nikoliv kyslíku) v průběhu oxidace glukózy dikyslíkem. Úlohu přenašeče elektronů mimo cytochromů zastává i řada nehemových bílkovin obsahujících železo (označují se zkratkou NHIP). Většinou jde o bílkoviny s malou molekulovou hmotností (6000 až 12000), pro něž je charakteristická přítomnost vazeb Fe-S (síra je součástí cysteinových zbytků v bílkovinném řetězci). Nejjednodušší z nich je rubredoxin obsahující jeden atom železa tetraedricky koordinovaný čtyřmi atomy síry. Ferredoxiny obsahují větší počet atomů Fe (dva, čtyři nebo osm) v jednotkách Fe2S2 nebo klastrech Fe4S4 (dva vzájemně prostoupené tetraedry Fe4 a S4 vytvářející společně deformovanou krychli) umožňující transfer jednoho elektronu.
Transferrin (glykoprotein s molekulovou hmotností 80000 schopný reverzibilně vázat dva atomy železa) přenáší železo ve formě FeIII do míst, kde je využíváno nebo do skladů (převážně do kostní dřeně). K uskladnění právě nepotřebného železa tam slouží ve vodě rozpustný ferritin obsahující až 20 % železa. Jeho slupka je z proteinu (má průměr 12,0 nm, molekulová hmotnost je asi 900000), jádro tvoří hydroxidofosforečnan železitý (jeho průměr je 7,5 nm, molekulová hmotnost činí asi 418000, jednotka obsahuje 4000 atomů železa s koordinačním číslem šest ve vrstevnaté struktuře).
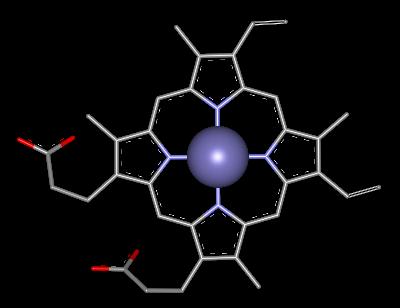
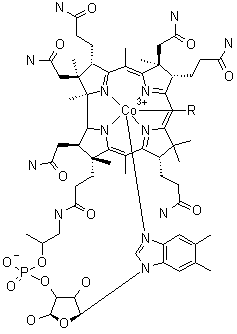
Kobalt je v lidském organismu obsažen v nepatrném množství (2-5 mg) a je koncentrován především v játrech. Na jeho význam pro vyšší organismy se přišlo v souvislosti s léčbou anemického onemocnění ovcí a hovězího dobytka (choroba byla nejprve se střídavými úspěchy léčena preparáty obsahujícími železo a teprve ve 30. letech bylo zjištěno, že úspěch léčby souvisí s přítomností kobaltu v používaných léčivech). Brzy nato byl z jater izolován kobalt obsahující vitamin B12, o němž je dnes známo, že se jako koenzym účastní řady biochemických procesů (nejdůležitějším z nich je tvorba červených krvinek). Koordinační sféra kobaltu v něm je blízce příbuzná s porfyrinovým systémem v hemu, jako čtyřfunkční dusíkatý ligand se uplatňuje korrinový systém. Formální oxidační číslo kobaltu je +III (v průběhu enzymatických procesů se mění na +II a +I) a zcela unikátním jevem je existence vazby kov-uhlík, protože vitamin B12 je jediná v přírodě se vyskytující organokovová sloučenina. Z přírodního materiálu se izoluje jako kyanokobalamin, v němž šesté koordinační místo obsazuje místo ribozofosfátu kyanidová skupina.
Chrom ve formě CrIII patří k esenciálním stopovým prvkům podílejících se na metabolických procesech savců včetně člověka (sloučeniny CrVI jsou naproti tomu karcinogeny), ale mechanismus jeho působení není dosud detailně znám.
Molybden je součástí nitrogenáz, některých reduktáz a oxidáz, většinou spolu s železem. Nejvýznamnější je úloha molybdenu při fixaci vzdušného dusíku a jeho přeměně na amoniak, kterou jsou schopny provést některé bakterie (rhizobium na kořenech luštěnin). Účinným metaloenzymem v tomto procesu je nitrogenáza složená ze dvou odlišných bílkovin. Jedna obsahuje vedle molybdenu ještě železo (bílkovina MoFe nebo molybdoferredoxin s molekulovou hmotností 220000 obsahuje dva atomy molybdenu, 24 až 36 atomů železa a přibližně stejný počet atomů síry), druhá pouze železo (bílkovina Fe nebo azaferredoxin s molekulovou hmotností 50000-70000 obsahující fragment Fe4S4). Prvním krokem fixace didusíku je vazba na bílkovinu MoFe prostřednictvím atomu molybdenu, následuje redukce bílkoviny Fe ferredoxinem a nakonec dochází k přenosu elektronů z redukované bílkoviny Fe na komplex bílkovina MoFe–N2, který usnadní protonizaci molekuly didusíku a vznik amoniaku. Molybden byl dlouho považován za jediný kov z vyšších přechodných řad, který je důležitý pro život, ale nedávno bylo zjištěno, že biochemicky aktivní je i wolfram jako součást bakteriálního enzymu (dehydrogenázy mravenčanu).
Měď je součástí bílkoviny hemocyaninu (molekulová hmotnost asi 1000000), která nahrazuje v krvi některých měkkýšů hemoglobin při přenosu kyslíku. V lidském těle je obsaženo cca 100 mg mědi (nejvíce po železe a zinku) a tato úroveň se udržuje denním příjmem tří až pěti miligramů (nedostatek vyvolává anemii, neschopnost těla vylučovat měď způsobuje Wilsonovu chorobu). Spolu s hemem se měď účastní v cytochromoxidaze přenosu elektronů (pár CuII/CuI přenáší elektron z hemu na molekulu dikyslíku a usnadňuje tak vznik vody). V rostlinách slouží k přenosu elektronů řada bílkovin obsahujících měď, které se vyznačují intenzivním zbarvením (modré bílkoviny).
Zinek je jeden z nejdůležitějších a zřejmě pro jakékoliv formy života nezbytným kovem (jeho těžší homology kadmium a rtuť nemají naproti tomu žádnou známou pozitivní biologickou úlohu a patří naopak k nejtoxičtějším prvkům). V těle člověka jsou obsaženy přibližně 2 g zinku rozptýleného do většiny buněk. Jeho koncentrace je proto nízká, obtížně se v biologickém materiálu prokazuje a dlouho se o jeho biochemickém významu nevědělo. Poprvé (1940) byl zinek detekován v karbonátdehydratáze (ovlivňuje rovnováhu reakce CO2 + H2O ↔ HCO3− + H+, kov je v ní koordinován tetraedricky), později (1955) v karboxypeptidáze A (katalyzuje hydrolýzu koncové peptidické vazby v bílkovinách v procesu trávení, má molekulová hmotnost 30000-35000 a zinek je v ní rovněž koordinován tetraedricky). Nyní je známo více než osmdesát enzymů obsahujících zinek (alkoholdehydrogenázy, aldolázy, transfosforylázy, fosfatázy).