Oxidační číslo
Oxidační číslo je náboj, který by byl přítomen na atomu prvku, kdyby elektrony každé vazby, která z něj vychází, byly přiděleny elektronegativnějšímu z vázaných atomů. [21]
Oxidační číslo prvku se zapisuje římskými číslice vpravo nahoře příslušného prvku přímo do chemického vzorce např. oxidační číslo vodíku ve vodě je +I a kyslíku −II, uvedená oxidační čísla se zapíší vpravo nahoru k prvku do chemického vzorce vody, H2IO−II. Oxidační čísla nabývají hodnot od −IV až po +VIII, u kladných hodnot se znak plus zpravidla vynechává. U elektroneutrální molekuly je součet oxidačních čísel všech atomů roven nule, u iontových sloučenin součet oxidačních čísel odpovídá náboji iontu. [21, 23]
Vazba mezi atomy shodného prvku nevede ke změně oxidačního čísla. Například kyslík je prvek tvořený dvouatomovými molekulami O2. Oba vázané atomy kyslíku (O=O) mají stejnou schopnost přitahovat vazebné elektronové páry (mají stejnou elektronegativitu), proto se jim nepřidělují náboje. Z toho vyplývá, že oxidační číslo obou kyslíkových atomů je rovno nule O0=O0,tedy O20. [21]
Neutrální atom prvku má oxidační číslo nula, např. Cu0, Na0. Některé prvky ve sloučeninách nabývají typických oxidačních čísel. Kyslík má zpravidla oxidační číslo rovno −II, např. ve sloučeninách CIVO2−II, C+IIO−II, S+IVO2−II, výjimkou tvoří peroxidy, kde kyslík má oxidační číslo −I, H+I − O−I − O−I − H+I, H2+IO2−I. Prvky první skupiny, alkalické kovy a vodík, mají většinou oxidační číslo rovno +I, výjimkou jsou iontové hydridy, kde vodík má oxidační číslo −I, např. v hydridu sodném má vodík oxidační číslo −I, Na+IH−I. Dalším příkladem prvků, které mají typická oxidační čísla, jsou prvky druhé skupiny, kovy alkalických zemin, jejichž typické oxidační číslo je rovno +II. [21]
Oxidační číslo se určuje následujícími způsoby. První možnost je využití definice, kdy se nejprve napíše strukturní vzorec molekuly, a poté podle elektronegativity přiřadíme náboj prvku, viz u ethanu. Druhým způsob je dopočtení oxidačního čísla, kdy se využívají typická oxidační čísla prvků. Tento způsob je podrobněji na vzorovém příkladu. [21, 23]
Zajímavost
Nula nebyla vždy obsažena v číselné soustavě, nenacházela se ani v římské soustavě číslic, ale používal se arabský zápis pro nulu „0“. Zrození nuly trvalo velmi dlouho, přispěla k tomu především Indie, i když Mayové používali nulu mnohem dříve, ale neovlivnili ostatní národy. Vítězství nuly v Evropě je spojeno hlavně s Leonardem Pisánským (Fibonacci) a jeho knihou Liber Abaci (1202). [31]
Řešené příklady
Určení oxidačního čísla podle definice
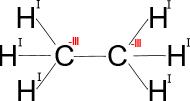
Molekula ethanu, H3C−CH3
V molekule ethanu má vodík oxidační číslo +I, protože uhlík má větší schopnost přitahovat vazebné elektronové páry. Vzájemná vazba mezi atomy uhlíku nepřispívá ke změně oxidačního čísla. Z toho plyne, že uhlík má oxidační číslo −III, viz Obrázek 1.
Dopočítání oxidačního čísla
-
NxH3+I
Součet oxidačních čísel je roven nule, protože amoniak je elektroneutrální molekula. Oxidační číslo vodíku je +I (vodík je elektropozitivnější než dusík), neznámé oxidační číslo dusíku označíme jako x. Napíše se rovnice následujícím způsobem. Vodík se v amoniaku vyskytuje třikrát NxH3+I, proto v rovnici figuruje 3 ∙ 1, přičte se oxidační číslo dusíku, tedy x. Součet oxidačních čísel je roven nule, z uvedených informací se sestaví rovnice:
x + 3 ∙ 1 = 0, x = −3,oxidační číslo dusíku je rovno –III. N−IIIH3+I .
-
SxO3−II
Oxidační číslo kyslíku je −II, protože kyslík je elektronegativnější než síra, má větší schopnost přitahovat vazebné elektronové páry. Stejným postupem sestavíme rovnici:
x − 2 ∙ 3 = 0, x = 6.Oxidační číslo síry je +VI. S+VIO3−II
-
H+IClxO−II
Vodík má oxidační číslo +I a kyslík –II, kyslík i vodík se v kyselině vyskytuje jedenkrát. Součet oxidačních čísel je roven nule, molekula je elektroneutrální. Rovnice je tvaru
1∙1 + x − 2 ∙ 1 = 0, x = 1.Oxidační číslo chloru v sloučenině je +I, H+IClIO−II, jde tedy o kyselinu chlornou.
-
H3+IPxO4−II
Vodík má oxidační číslo +I a vyskytuje se třikrát (3 ∙ 1), kyslík má oxidační číslo rovno –II a v kyselině je právě čtyřikrát (−2 ∙ 4). Oxidační číslo fosforu se označí jako neznámá x. Uvedená molekula je elektroneutrální, z toho vyplývá, že součet oxidačních čísel je roven nule. Rovnice je tvaru
3 ∙ 1 + x − 2 ∙ 4 = 0, x = 5.Oxidační číslo fosforu v kyselině je +V. H3+IP+VO4−II
-
(SxO4−II)−2
Kyslík má oxidační číslo –II a v daném iontu jsou obsaženy právě čtyři atomy kyslíku (−2 ∙ 4). Součet oxidačních čísel v iontu je roven −2. Rovnice je tvaru
x − 2 ∙ 4 = −2, x = 6.Oxidační číslo síry je rovno +VI. (SVIO4−II)−2
-
(Cr2xO7−II)−2
Oxidační číslo kyslíku je rovno –II, je obsažen sedmkrát (−2 ∙ 7). Oxidační číslo chromu označíme jako neznámou x, chrom je obsažen dvakrát, proto se do rovnice zapíše 2x. V iontu je součet oxidačních čísel roven −2. Rovnice má tvar
2x − 2 ∙ 7 = −2, x = 6.Oxidační číslo chromu v iontu je rovno +VI. (Cr2+VIO7−II)−2