Elektronová konfigurace
Nejdříve, než se dostane k samotné elektronové konfiguraci atomu, bude pojednáno o stavbě elektronového obalu a základních pojmech a pravidlech, které s ním souvisí.
1 Stavba elektronového obalu atomu
Elektron je nositel záporného elektrického náboje a má nepatrnou hmotnost, tj. přibližně 1 840krát menší než hmotnost protonu. Elektron tvoří obal atomu a má na základě typu experimentu „dvojí povahu“, tzn. elektron se v některých situacích chová jako vlnění, v jiných jako částice. Vlnový charakter elektronu, který lze chápat jako šíření vzruchu ve hmotném prostředí, je příčinou, že energie elektronu může nabývat jen určitých hodnot. Částice má hmotnost a je to ohraničený útvar, u kterého lze určit polohu i dráhu, po které se pohybuje. Ale přesnou polohu elektronu o určité energii v elektronovém obalu nelze zjistit, proto z těchto důvodů je nutné při popisu stavby elektronového obalu opustit představu pohybu elektronu po drahách a nahradit dráhy pojmem orbital. Orbital je část prostoru v okolí jádra atomu, kde se s největší pravděpodobností (95 %) vyskytuje elektron. [21], [38]
K popsání chování elektronu v elektronovém obalu se používají kvantová čísla.
2 Kvantová čísla
Hlavní kvantové číslo n
Elektrony se nacházejí v různých energetických hladinách elektronového obalu atomu, jejichž energie se vzdáleností od jádra roste. Energii a velikost orbitalu charakterizuje hlavní kvantové číslo n, které nabývá hodnot 1, 2, až ∞, někdy se označují 1 = K, 2 = L, 3 = M, … Elektrony ve sféře 1 (K) nejblíže u jádra mají nejmenší energii, elektrony v poslední sféře (valenční) mají nejvyšší energii. [21], [22]
Vedlejší kvantové číslo l
Vedlejší kvantové číslo l charakterizuje typ orbitalu, nabývá hodnot od 0 po n − 1 (např. pro hlavní kvantové číslo n = 3 je vedlejší kvantové číslo l rovno 0, 1 a 2). Vedlejší a hlavní kvantové číslo rozhoduje o energii elektronu a tvaru orbitalu. V následující podkapitole budou popsány jednotlivé tvary a prostorové orientace orbitalů, které jsou uvedeny v Tabulce 3. Vedlejšímu kvantovému číslu 0 odpovídá orbital typu s, 1 odpovídá orbital typu p, 2 odpovídá orbital typu d a vedlejšímu kvantovému číslu 3 odpovídá orbital typu f. [21, 22]
| Vedlejší kvantové číslo | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Typ orbitalu | s | p | d | f |
Magnetické kvantové číslo m
Magnetické kvantové číslo m určuje prostorovou orientaci jednotlivých orbitalů vzhledem trojrozměrné kartézské soustavy souřadnic. Toto číslo nabývá hodnot od −l po +l. Počet těchto hodnot udává počet orbitalů daného typu ve sféře. Orbitaly, které mají stejné hlavní a vedlejší kvantové číslo, ale různé magnetické kvantové číslo (různou orientaci), se nazývají degenerované orbitaly. Např. pro vedlejší kvantové číslo dvě (l = 2) je magnetické číslo rovno m = -2, -1, 0, 1, 2. [21], [34]
Spinové kvantové číslo ms
Popisuje vnitřní moment hybnosti elektronu a určuje spin elektronu (rotaci elektronu kolem vlastní osy). Nabývá pouze hodnot +1/2 a-1/2. [21]
Kvantovým číslům, která byla popsána výše, odpovídají určité tvary, velikosti a orientace orbitalů, které jsou popsány v následující podkapitole. Shrnutí kvantových čísel je uvedeno v Tabulce 4.
| Kvantové číslo | Poznámka | |||
|---|---|---|---|---|
| hlavní n | vedlejší l | magnetické m | ||
| určuje energii a velikost | charakterizuje tvar orbitalů | určuje orientaci orbitalů | ||
| 1 | 0 | orbital s | 0 | ve sféře je 1 orbital s |
| 2 | 0 | orbital s | 0 | ve sféře je 1 orbital s |
| 1 | orbital p | −1, 0, +1 | ve sféře jsou 3 orbitaly p | |
| 3 | 0 | orbital s | 0 | ve sféře je 1 orbital s |
| 1 | orbital p | −1, 0, +1 | ve sféře jsou 3 orbitaly p | |
| 2 | orbital d | −2, −1, 0, +1, +2 | ve sféře je 5 orbitalů d | |
| 4 | 0 | orbital s | 0 | ve sféře je 1 orbital s |
| 1 | orbital p | −1, 0, +1 | ve sféře jsou 3 orbitaly p | |
| 2 | orbital d | −2, −1, 0, +1, +2 | ve sféře je 5 orbitalů d | |
| 3 | orbital f | −3, −2, −1, 0, +1, +2, +3 | ve sféře je 7 orbitalů f | |
3 Tvary a prostorová orientace atomových orbitalů
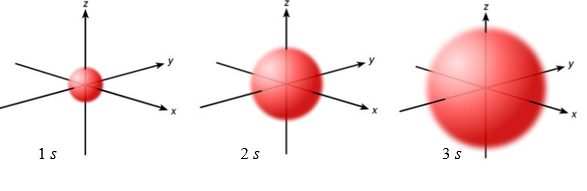
Orbital, jehož vedlejší kvantové číslo je rovno nule (l = 0), se označuje jako orbital s. Má tvar koule, jejíž poloměr závisí na hlavním kvantovém čísle n, s rostoucí hlavním kvantovým číslem n se poloměr koule zvětšuje, viz Obrázek 4. [21], [22]
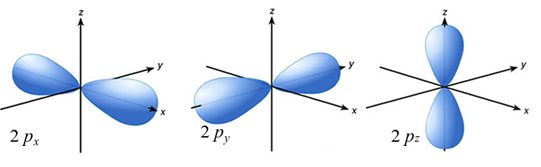
Orbitaly, jehož vedlejší kvantové číslo je rovno jedné (l = 1), se označují jako orbitaly p. Má tvar prostorové osmičky. Je charakteristické, že v každé vrstvě elektrováno obalu jsou tři orbitaly typu p. Vyplývá to z počtu hodnot magnetického kvantového čísla (m = -1, 0, 1), které rozhoduje o orientaci orbitalů p v prostoru, mohou být orientovány podle os x, y a z. A označují se postupně px, py a pz, viz Obrázek 5 . Všechny tři mají stejnou energii, ale liší se prostorovou orientací, tj. jsou energeticky degenerované. [21], [22]
Degenerované orbitaly mají stejnou hodnotu hlavního a vedlejšího kvantového čísla, ale liší se v čísle magnetickém. [21]
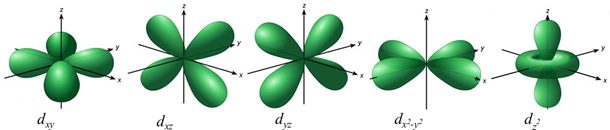
Orbitaly, jehož vedlejší kvantové číslo je rovno dvěma (l = 2), se označují jako orbitaly d. Mají složitější tvar, viz Obrázek 6. Vedlejšímu kvantovému číslu odpovídá pět hodnot magnetického kvantového čísla (m = -2, -1, 0, 1, 2), tedy i pět různých orbitalů, které mají stejnou energii, ale liší svou orientací (degenerované orbitaly). Leží v rovině určené osami x a y (dxy), v rovině xz (dxz), v rovině mezi osami y a z (dyz), leží na osách x a y (dx2 - y2), pátý orbital má specifický tvar (dz2). [21], [22]
Pro vedlejší kvantové číslo rovno třem (l = 3) nabývá magnetické kvantové číslo sedmi hodnot (m = -3, -2, -1, 0, 1, 2, 3), tzn. existuje sedm energeticky rovnocenných orbitalů, které se liší svojí prostorovou orientací, viz Obrázek 7. Tyto orbitaly se označují jako orbitaly f. [21]
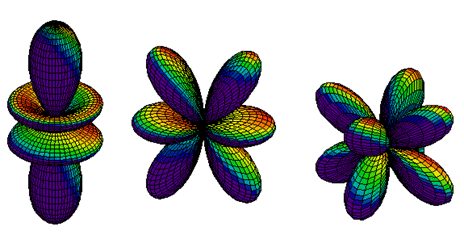
Než bude pojednáno o samotné elektronové konfiguraci atomů a iontů a pravidlech pro zaplňování orbitalů, bude v následující kapitole popsáno, jak se znázorňují jednotlivé orbitaly a elektrony.
4 Znázornění a zápis elektronů a orbitalů
Počet elektronů v každém orbitalu určuje počet hodnot spinového čísla, tj. dvě hodnoty. Z toho vyplývá, že v orbitalu mohou být maximálně dva elektrony, které liší spinovým číslem (Pauliho princip, viz dále). Elektrony se značí ↑ nebo ↓, směr šipky znázorňuje jejich opačný spin. Orbital s obsahuje maximálně dva elektrony, podslupka s vedlejším kvantovým číslem 1 obsahuje tři degenerované orbitaly p, pojímá maximálně šest elektronů. Podslupka s vedlejším kvantovým číslem 2 je tvořena pěti degenerovanými orbitaly d, obsahuje nejvýše deset elektronů. Podslupka s l = 3 je tvořena sedmi degenerovanými orbitaly f, může nejvýše pojímat čtrnáct elektronů. Orbitaly lze znázorňovat pomocí rámečku nebo pomocí kvantových čísel. [22]
Rámečkový diagram značí všechny orbitaly stejně velkými rámečky, jestliže jsou degenerovány, spojí se odpovídající rámečky do jednoho celku, viz Obrázek 8. [21]
Hlavní kvantové číslo n se zapisuje pomocí arabských číslic před označení orbitalů podle vedlejšího kvantového čísla (s, p, d, f, …). Elektrony se zapisují jako šipky v rámečkovém diagramu nebo jako horní index při značení orbitalu v zápisu pomocí kvantových čísel. Např. 3p4 (čti: „tři pé čtyři“) poskytuje informaci, že v orbitalech p (vedlejší kvantové číslo je rovno jedné) třetí vrstvy (hlavní kvantové číslo je rovno třem) se nachází 4 elektrony (horní index nebo šipky), grafické znázornění je na Obrázku 9. Skutečnost, že v jednom orbitalu jsou dva elektrony, se zapisuje pomocí šipek opačného směru, viz Obrázek 9 a Obrázek 10. Pravidla pro obsazování orbitalů budou popsána v další kapitole. [21], [22]
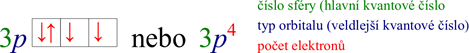

5 Pravidla pro obsazování orbitalů
Pro zaplňování orbitalů platí tři pravidla, která zde budou uvedena.
1 Pauliho vylučovací princip
Pauliho vylučovací princip nebo též Pauliho princip výlučnosti říká, že v atomu neexistují dva elektrony, které by měly všechna čtyři kvantová čísla (n, l, m a ms) shodná. Proto v jednom orbitalu mohou být jen dva elektrony, které se liší spinovým číslem, a tvoří elektronový pár. Z tohoto principu vyplývá i maximální počet elektronů v jednotlivých orbitalech s, p, d a f, viz předchozí kapitola. Tento fakt je znázorněn na Obrázku 10. [21], [34]
2 Hundovo pravidlo
V degenerovaných orbitalech se nejdříve orbitaly zaplní jedním elektronem, který má stejné spinové číslo, a poté vznikají elektronové páry. Všechny nespárované elektrony mají stejný spin. Důvodem je, že systém má nejnižší energii, a tím je stabilnější. Příklad je uveden níže nebo na Obrázku 9. [22]
Příklad 7:
3d7 znamená, že v třetí vrstvě (hlavní kvantové číslo je tři) je v orbitalech d (vedlejší kvantové číslo dvě) sedm elektronů (index u d je roven 7). Při zápisu 3d7 pomocí rámečkového diagramu se nejdříve každý orbital zaplní jedním elektronem, všechny se stejným spinem (stejný směr šipek). Při tomto kroku se umístí pět elektronů, zbylé dva (7 - 5) elektrony se umístí s opačným spinem do libolných dvou orbitalů, viz Obrázek 11 (libovolných, protože orbitaly jsou energeticky degenerovány).
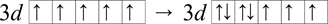
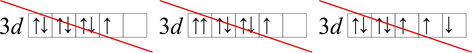
Níže jsou uvedeny špatné znázornění elektronů. V prvním diagramu nedošlo k zaplnění nejdříve jedním elektronem (nedodržení Hundova pravidla). Na druhém diagramu je opět porušeno Hundovo pravidlo a také i Pauliho princip, v jednom orbitalu jsou dva elektrony, které mají stejná všechna čtyři kvantová čísla (v jednom orbitalu jsou dva elektrony, které mají stejný směr). Na posledním digramu není zachováno Hundovo pravidlo, protože nespárované elektrony nemají stejný spin (nemají stejný směr šipek), viz Obrázek 12.
3 Výstavbový princip
Orbitaly s nižší energií se zaplňují dříve než orbitaly s vyšší energií. Energie se zvyšuje s rostoucí hodnotou součtu hlavního kvantového čísla n a vedlejšího kvantového čísla l (n+l). Pokud orbitaly mají stejnou energii (stejná hodnota n+l ), pak rozhoduje hlavní kvantové číslo n, např. u 4s a 3p je výše zmíněný součet roven 4, orbital 3p má nižší hlavní kvantové číslo, tj. 3, proto má nižší energii a zaplní se dříve. [21], [22]
Příklad 8:
Seřaďte orbitaly podle zvyšující se energie: 2s, 5s, 6d, 2p, 3d a 3s.
Nejdříve se určí hodnota n + l.
- pro 2s je 2 (2 + 0)
- pro 5s je 5 (5 + 0)
- pro 6d je 8 (6 + 2)
- pro 2p je 3 (2 + 1)
- pro 3d je 5 (3 + 2)
- pro 3s je 3 (3 + 0)
5s a 3d mají stejnou hodnotu součtu hlavního a vedlejšího kvantového čísla, protože 3d má menší hodnotu hlavního kvantového čísla n, tím i nižší energii, proto 3d bude umístěno před 5s. 2p a 3s mají také stejnou hodnotu n + l, na základě hodnoty hlavního kvantového čísla bude 2p před 3s. Nyní na základě předchozího komentáře a rostoucí hodnoty n + l budou orbitaly seřazeny následovně.
2s - 2p - 3s - 3d - 5s - 6d
Pořadí, ve kterém se zaplňují orbitaly, je následující:
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s - 4f - 5d - 6p - 7s - 5f - 6d - 7p - … [22]
6 Elektronová konfigurace prvků
Elektronová konfigurace je uspořádání elektronů v elektronovém obalu atomu. Při zápisu se musí dodržovat pravidla pro zaplňování orbitalů elektrony. Zápis je možný několika způsoby buď pomocí rámečkového diagramu nebo pomocí kvantových čísel. Vše bude ukázáno na konkrétních příkladech.
Příklad 9:
Jaká je elektronová konfigurace sodíku, fosforu a železa?
Sodík 11Na je prvek, který má protonové číslo rovno 11, z toho plyne, že sodík má 11 elektronů. Nejdříve se napíše posloupnost orbitalů podle výstavbového principu, do kterých se následně podle Hundova pravidla a Pauliho vylučovacího principu postupně zapíše 11 elektronů. Pro fosfor a železo se postupuje analogicky.
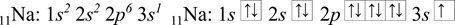
Fosfor 15P má 15 elektronů.

Železo 26Fe má 26 elektronů. Nejdříve se zapíše posloupnost orbitalů podle výstavbového principu, a poté podle pravidel se zaplní elektrony. Poslední čtyři elektrony mají stejný spin. Ale výsledná elektronová konfigurace atomu se zapíše podle rostoucího hlavního kvantového čísla, tj. při zápisu elektronové konfigurace železa se prohodí orbitaly 4s a 3d. Protože při zaplnění orbitalů elektrony se energie jednotlivých orbitalů mění, tj. 4s má vyšší energii než 3d (zápis je proveden podle rostoucí energie).
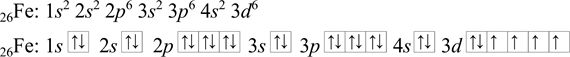
Výsledná elektronová konfigurace železa:
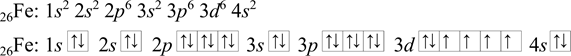
Je vidět, že čím je větší protonové číslo, tím je elektronová konfigurace delší. Chemické a fyzikální vlastnosti látek jsou také i důsledkem obsazení valenční vrstvy atomu elektrony, tj. počet valenčních elektronů. Proto je výhodné psát elektronovou konfiguraci tzn. zkráceným zápisem. Kde se využívá nejbližší předchozí vzácný plyn (prvky 18. skupiny). Vše bude ukázáno na příkladu. [21], [38]
Příklad 10:
Pomocí zkráceného zápisu elektronové konfigurace uveďte elektronové konfigurace sodíku, fosforu a železa.
Z předchozího příkladu je známá elektronová konfigurace sodíku. Při zkráceném zápisu se využije nejbližší vzácný plyn, který předchází sodíku, tj. neon. Žlutě je zvýrazněná elektronová konfigurace neonu. Žlutá část se nahradí značkou pro neon.
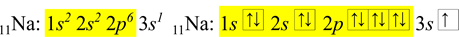
Ve zkráceném zápisu se zapíše nejdříve prvek, kterého je elektronová konfigurace, následně předchozí vzácný plyn do hranatých závorek, a nakonec zbylé elektrony.
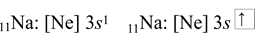
Postup při zkráceném zápisu elektronové konfigurace fosforu je obdobný. Nejbližší předchozí vzácný plyn je neon, viz žlutě zvýrazněné oblasti. Ve zkráceném zápise se za fosfor napíše značka vzácného plynu do hranatých závorek, a nakonec zbylé elektrony.
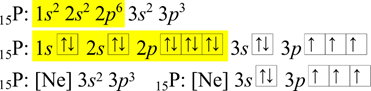
U železa se postupuje analogicky. Předcházejí vzácný plyn je argon.

Na základně uvedených znalostí se určuje i elektronová konfigurace atomových iontů. Platí stejná pravidla jako u elektronové konfigurace neutrálních atomů, na příkladu budou ukázaný elektronové konfigurace iontů 〖Li〗^+,N^(+III) v nezkráceném i zkráceném zápisu.
Příklad 11:
Určete elektronové konfigurace Li+, N+III.
Lithium má tři elektrony, po odebrání jednoho elektronu vzniká kation lithný Li+, který má dva elektrony. Elektronová konfigurace je shodná s konfigurací helia 2He.
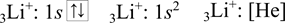
Dusík má sedm elektronů, při odebrání tří elektronů z valenční vrstvy vzniká hypotetický kation N+III, který má čtyři elektrony. Podle pravidel pro zaplňování orbitalů elektrony se zapíše následující elektronová konfigurace.
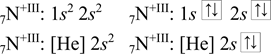
Někdy vznikají elektronové konfigurace jiné, než striktním uplatněním předchozích pravidel. Nepravidelnost elektronové konfigurace může být způsobena např. symetrií orbitalů, větší stabilitou zcela nebo napůl obsazených orbitalů (d, f). V Tabulce 5 je uveden seznam atomů s nepravidelnými elektronovými konfiguracemi. [34], [40], [41]
| prvek | elektronová konfigurace | prvek | elektronová konfigurace |
|---|---|---|---|
| chrom | Cr:[Ar] 3d5 4s1 | platina | Pt:[Xe] 4f14 5d9 6s2 |
| měď | Cu: [Ar] 3d10 4s1 | zlato | Au: [Xe] 4f14 5d10 6s1 |
| molybden | Mo: [Kr] 4d5 5s1 | thorium | Th:[Rn] 6d2 7s2 |
| ruthenium | Ru: [Kr] 4d7 5s1 | protaktinium | Pa:[Rn] 5f2 6d1 7s2 |
| rhodium | Rh: [Kr] 4d8 5s1 | uran | U: [Rn] 5f3 6d1 7s2 |
| palladium | Pd: [Kr] 4d10 5s0 | neptunium | Np: [Rn] 5f4 6d1 7s2 |
| stříbro | Ag: [Kr] 4d10 5 s1 | curium | Cm: [Rn] 5f7 6d1 7s2 |
| cer | Ce:[Xe] 4f1 5d1 6s2 | darmstadtium | Ds: [Rn] 5f14 6d9 7s1 |
| gadolinium | Gd: [Xe] 4f7 5d1 6s2 | roentgenium | Rg: [Rn] 5f14 6d10 7s1 |
Na závěr kapitoly bude stručné pojednání o periodách a skupinách v periodické soustavě prvků, jak souvisí s kvantovými čísly.
7 Perioda
Hlavní kvantové číslo n valenční elektronové vrstvy odpovídá pořadovému číslu periody, ve které se prvek nachází.
Hlavnímu kvantovému číslu jedna odpovídá pouze jedna hodnota vedlejšího kvantového čísla (n = 1, l = 0). Z toho plyne, že první elektronová vrstva obsahuje pouze orbital s, k jehož zaplnění jsou třeba dva elektrony, tzn. v první periodě se nacházejí pouze dva prvky, tj. vodík a helium.
Hlavnímu kvantovému číslu dvě odpovídají dvě hodnoty vedlejšího kvantového čísla (n = 2, l = 0 a 1). Druhá elektronová vrstva obsahuje orbitaly typu s a p, k jejichž úplnému zaplnění je třeba 8 (2 + 6) elektronů. A skutečně, v druhé periodě se nachází osm prvků, z toho dva, které mají elektrony pouze v orbitalu s (lithium a beryllium), a šest, které mají elektrony v orbitalech s a p (bor, uhlík, dusík, kyslík, fluor a neon).
Atomy prvků v třetí periodě, s hlavním kvantovým číslem 3, mají své elektrony v orbitalech 1s, 2s, 2p, 3s a 3p.
Podle pravidla n + l po 3p následuje 4s, 3d a 4p. Ve čtvrté periodě elektrony draslíku a vápníku zaplňují orbital 4s, poté následuje 10 prvků (od skandia až po zinek), jejichž elektrony zaplňují orbitaly 3d. Těchto deset prvků jsou označovány jako d-prvky nebo také přechodné prvky, protože doplňují elektrony do předposlední vrstvy elektronového obalu. Ve čtvrté periodě se ještě nachází dalších šest prvků, které zaplňují orbital 4p (od gallia až po krypton).
Pátá perioda je analogická s periodou čtvrtou.
Jako s-prvky jsou označovány prvky, které obsazují valenční orbital s, nacházejí se v první a druhé skupině periodické soustavy prvků. Jako p-prvky jsou označovány prvky, které doplňují elektrony do valenčního orbitalu p. P-prvky se nacházejí v 13. až 18. skupině periodické soustavy prvků. Dohromady se s-prvky a p-prvky se nazývají nepřechodné prvky.
V šesté a sedmé periodě, které odpovídají hlavnímu kvantovému číslu šest a sedm, se kromě nepřechodných a přechodných prvků se nacházejí i prvky vnitřně přechodné, které doplňují elektrony do orbitalu f. F-prvků je v každé periodě celkem 14, což odpovídá maximálnímu počtu elektronů v orbitalu f. Tyto prvky se označují také jako lanthanoidy a aktinoidy. [21]
8 Skupina
V periodické soustavě prvků se nachází 18 skupin, do kterých jsou seřazeny prvky pod sebou. Prvky ve stejné skupině mají stejný počet elektronů v poslední (případně v předposlední) vrstvě elektronového obalu, mají podobné chemické vlastnosti, jež jsou určeny strukturou a obsazením valenční sféry elektrony. Valenční elektrony jsou elektrony s nejvyšší energií, u nepřechodných prvků se nacházejí v orbitalech ns a np, u přechodných prvků v orbitalech ns a (n – 1)d a vnitřně přechodných prvků v orbitalnsh nn, (n d 1)d a (n - 2)f. [21]m>. [21]
Valenční elektrony se dají snadno vyčíst ze zkráceného zápisu elektronové konfigurace, tento postup bude ukázán u prvků z Příkladu 10 a Příkladu 11, tj. u sodíku, fosforu, železa a bromu a iontů 〖Li〗^+,N^(+III).
Příklad 12:
Určete počet valenčních elektronů u sodíku, fosforu, železa, bromu a iontů Li+, N+III.
Sodík
Sodík je s-prvek, jeho valenční elektron se nachází v orbitalu 3s (ns). V zápisu zkrácené elektronové konfigurace pomocí kvantových čísel stačí sečíst hodnoty horních exponentů u s a p orbitalů, tj. 1 (3s1 ). Při konfiguraci pomocí rámečkového diagramu se sčítají počty šipek, které označují elektrony, tj. 1. Atom sodíku obsahuje jeden valenční elektron.
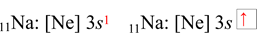
Fosfor
Fosfor je p–prvek, valenční elektrony se nachází v orbitalech 3s a 3p (ns a np). V zápisu zkrácené elektronové konfigurace pomocí kvantových čísel je vidět, že fosfor má pět valenčních elektronů (3s2 3p3, 2 + 3 = 5 ), což lze vyčíst i z rámečkového diagramu (obsahuje 5 šipek, které představují jednotlivé elektrony).
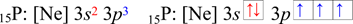
Železo
Železo je d-prvek, valenční elektrony se nachází v orbitalech 3s a 3d (ns a (n-1)d). Železo obsahuje osm valenčních elektronů (3d6 4s2, 6 + 2 = 8). Počet elektronů v rámečkovém diagramu je 8 (osm šipek).
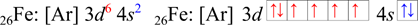
Brom
Brom je p–prvek, valenční elektrony se nachází pouze v orbitalech 4s a 4p (ns a np), nepočítají se elektrony z d orbitalu! V zápisu zkrácené elektronové konfigurace pomocí kvantových čísel je vidět, že brom má sedm valenčních elektronů (4s2 4p5, 2 + 5 = 7 ), lze vyčíst i z rámečkového diagramu (obsahuje 7 šipek).
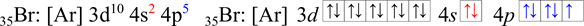
Kation Li+
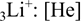
Kation lithia Li+ nemá žádný valenční elektron.
Kation N+III
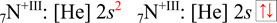
Hypotetický kation dusíku N+III má dva valenční elektrony (2s2).