
Jaký bude potenciál soustavy, která obsahuje chlorid železnatý a železitý v molárním poměru 1:10? Standardní potenciál soustavy Fe3+/Fe2+ je 0,771 V.
Elektrodové potenciály
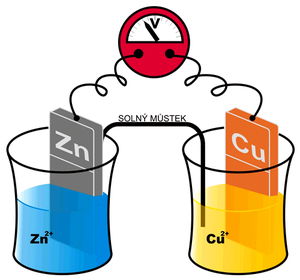
Galvanický článek je tvořen dvěma elektrodami, kovovými vodiči ponořenými do roztoku elektrolytu. Při tomto ponoření nepatrné množství kationtů přejde z elektrody do roztoku. Povrch elektrody je nyní záporně nabit vůči roztoku a ustaví se na něm standardní elektrický potenciál. Každý z kovů se v roztoku nabije různě.Rozdíl potenciálů je rovnovážné napětí.
Příkladem galvanického článku je Daniellův článek.
Vztah mezi potenciálem kovové elektrody a aktivitou jejich iontů v roztoku u jejího povrchu vyjadřuje
Nernstova-Petersova rovnice:
Při nízkých koncentracích roztoků je možné při výpočtech místo aktivit dosadit koncentrace redoxních párů, potom bude rovnice vypadat:
\[\boldsymbol{{\color{DarkRed} E =E^{0}+\frac{R \cdot T}{z \cdot F}ln\frac{[ox]}{[red]} }\ }\tag{1.6}\]
Rovnici ve zjednodušeném tvaru po dosazení konstant (platí pro 25 °C):
\[\boldsymbol{{\color{DarkRed} E =E^{0}+\frac{0,0592}{z}log\frac{[ox]}{[red]} }\ }\tag{1.7}\]
Výpočetní vztah za předpokladu, že se redukovaná koncentrace bere jako jednotková:
\[\boldsymbol{{\color{DarkRed} E =E^{0}+\frac{0,0592}{z} log c }\ }\tag{1.8}\]
Vysvětlivky k použitým značkám:
E0...standardní elektrodový potenciál [V]
E...elektrodový potenciál [V]
R...molární plynová konstanta 8,314 [J·K-1·mol-1]
T... teplota (273,15 + °C) [K]
z... počet vyměněných elektronů
F...Faradayova konstanta 96 487 [C·mol-1]
Ze zadání víme, že molární poměr Fe2+ a Fe3+ je 1:10.
Vycházíme ze vztahu (1.7): \[\boldsymbol{{\color{DarkRed} E =E^{0}+\frac{0,0592}{z}log\frac{[ox]}{[red]} }\ }\]
Po dosazení: \[E =0,771+\frac{0,0592}{1}log\frac{10}{1}= {\color{DarkGreen}\mathbf{0,830\;V}}\]
Potenciál soustavy bude 0,830 V.

Bude se daný kov rozpuštět ve zředěné kyselině chlorovodíkové, jestliže standardní potenciál Mn2+/Mn je -1,180 V?
Čím kov ochotněji záporně nabije svůj povch tj. přejde malé množství kationtů do roztoku, tím je reaktivnější a má nižší standardní elektrodový potenciál. Kovy můžeme na základě tohoto potenciálu porovnávat.
Čím má kov nižší standardní potenciál než vodík, je reaktivnější, čili snadněji vytěsňuje plynný vodík z kyseliny.
Př: Mn + 2 HCl → MnCl2 + H2.
V případě, že standardní elektrodový potenciál kovu je vyšší než vodíku reakce se zředěnou kyselinou chlorovodíkovou neproběhne:
Ag + HCl → nereaguje
Kovy jsou v tzv.Beketově řadě seřazeny dle jejich standardního elektrodového potenciálu. Kovy rozlišujeme na neušlechtilé a ušlechtilé, mezi nimi "stojí" vodík. Kovy nalevo od vodíku mají záporný elektrodový potenciál, jsou neušlechtilé, budou se rozpouštět ve zředění HCl. Kovy napravo od vodíku mají kladný elektrodový potenciál, jsou ušlechtilé, tudíž se nebudou rozpouštět ve zředěné HCl.
Beketova řada
Li Rb K Ba Sr Ca Na Mg Be Al Ti Mn Zn Cr Fe Co Ni Sn Pb H Mo Cu Ag Hg Pd Ir Pt Au
Nejreaktivnější jsou kovy první a druhé skupiny, budou vyvíjet vodík i ze slabých kyselin. Čím více se budou kovy v řadě zleva blížit k vodíku, tím budou s neoxidujícími kyselinami reagovat neochotněji.
Mn2+/Mn má záporný standardní potenciál, stojí v Becketově řadě nalevo od vodíku, bude se ve zředěné HCl rozpouštět.



 Nápověda
Nápověda Řešení
Řešení
