
Kov byl rozpuštěn v kyselině chlorovodíkové a roztok podroben elektrolýze. Nábojem 3208 C se na katodě vyloučilo 1,7427 g kovu. Vypočítejte oxidační číslo kovu.
Ar(kovu) = 157,25
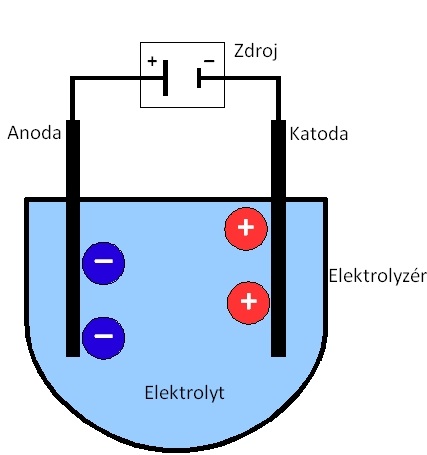
Elektrolýza
Elektrolýza je děj, při kterém dochází k rozkladu roztoku elektrolytu (tavenina nebo roztok iontových sloučenin) procházejícím stejnosměrným elektrickým proudem. Proud je do roztoku zaváděn prostřednictvím katody a anody. Jedná se o redoxní děj, dochází při něm ke změnám oxidačních čísel atomů. Na katodě probíhá redukce, na anodě oxidace.
redukce - dokází ke snižování oxidačního čísla, redukovaná látka přijímá elektrony
oxidace - dokází ke zvyšování oxidačního čísla, oxidovaná látka odevzdává elektrony
Redukce a oxidace probíhají současně, jedna látka elektrony přijímá, druhá je odevzdává tak, aby počet přijatých a odevzdaných elektronů byl stejný.
Elektrolýza roztoku kuchyňské soli:
Jednotlivé poloreakce:
Ionty Na+ z roztoku po zapojení elektrického proudu putují k záporné elektrodě, kde se redukují, vznikne sodík. Protože reakce probíhá ve vodném prostředí sodík reaguje s vodou za vzniku hydroxidu sodného a vodíku.
\[KATODA: 2 H_{2}O + 2 e^- → 2 OH^- + H_2.....redukce\]
Ionty Cl-putují k anodě, kde se oxidují a vzniká chlór.
\[ANODA: 2 Cl^{-} - 2e^- → Cl_2.....oxidace\]
Souhrnná rovnice: \[\mathbf{2 NaCl + 2 H_2O →2 NaOH + Cl_2 + H_2}\]
Elektrický náboj, který prošel kapalinou během elektrolýzy do zdroje, je roven absolutní hodnotě elektrického náboje elektronů dodaných zdrojem do katody či odvedených z anody do zdroje.
Faradayův zákon
1. Faradayův zákon:
Hmotnost vyloučené látky je přímo úměrná náboji, který prošel elektrolytem.Vzhledem k tomu, že každý kation vylučovaného kovu přijme při elektrolýze počet elektronů odpovídající jeho náboji, o určité hmotnosti přenese určitý náboj, vztah mezi celkovou hmotností vyloučeného kovu a celkovým přeneseným nábojem Q je přímá úměra:
\[\boldsymbol{{\color{DarkRed} m = A \cdot Q}}\tag{1.1}\]
Elektrochemický ekvivalent A je konstanta charakterizující látky, které se vylučují na elektrodách při elektrolýze. Udává, kolik látky v kg se vyloučí na elektrodách elektrickým nábojem o velikosti 1 coulomb. Velikost elektrochemického ekvivalentu pro různé látky najdeme v tabulkách.
2. Faradayův zákon
Tento zákon vyjadřuje konstantu úměrnosti A pro danou látku, tzv. elektrochemický ekvivalent:\[\boldsymbol{{\color{DarkRed} A= \frac{M}{F \cdot z}}}\tag{1.2}\]
Elektrochemický ekvivalent A závisí přímo úměrně na molární hmotnosti látky.
Pro výpočet hmotnosti vyloučeného kovu tedy platí:
\[\boldsymbol{{\color{DarkRed} m =\frac{M \cdot Q}{F \cdot z}}}\tag{1.3}\]
Při konstantním elektrickém proudu též platí:
\[\boldsymbol{{\color{DarkRed}Q = I \cdot t}}\tag{1.4}\]
Vysvětlivky k použitým značkám:
z... počet elementárních nábojů nesených ionty látky v roztoku
Q = 3208 C m = 1,7427 g M = 157,25 g·mol-1 F = 96 487 C·mol-1 Při řešení vyjdeme ze spojeného vztahu 1.3: \[\boldsymbol{{\color{DarkRed} m =\frac{M \cdot Q}{F \cdot z}}}\] Vyjádříme ze vzorce z a dosadíme příslušné hodnoty: \[z=\frac{M \cdot Q}{F \cdot m}=\frac{157,25 \cdot 3208}{96487 \cdot 1,7427}≈ \mathbf{{\color{DarkGreen} 3}}\] Oxidační číslo kovu je 3.
F...Faradayova konstanta, která odpovídá 96 487 [C·mol-1]
M...molární hmotnost látky vyloučené na elektrodě [g·mol-1]
m...hmotnost látky vyloučené na elektrodě [g]
I...proud [A]
t...doba, kterou proud procházel [s]




 Nápověda
Nápověda