Hydrid beryllnatý BeH2 je bílá, netěkavá látka s polymerní řetězovou strukturou.
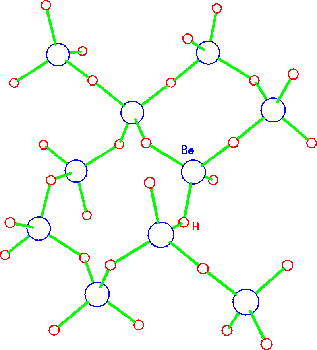
Připravuje se reakcí chloridu beryllnatého (nebo Be(CH3)2) s tetrahydridohlinitanem lithným v diethyletheru, případně účinkem atomárního vodíku na kovové beryllium.
Acetylid beryllnatý BeC2 se tvoří působením acetylenu na beryllium, karbid beryllnatý Be2C vzniká reakcí prvků. S vodou nebo s roztoky alkalických hydroxidů reaguje Be2C za tvorby methanu (analogicky jako karbid hlinitý Al4C3).
Bílý oxid beryllnatý BeO má vysoký bod tání (2570 °C) i tvrdost (9 v Mohsově stupnici). Krystaluje ve wurtzitové struktuře (na rozdíl od všech oxidů kovů alkalických zemin) signalizující převážně kovalentní charakter vazeb Be-O. Jeho vlastnosti závisí na způsobu přípravy. V mikrokrystalické formě zí skané termickým rozkladem uhličitanu nebo hydroxidu beryllnatého se rozpouští ve zředěných kyselinách, po vyžíhání (1800 °C) nebo přetavení je rozpustný pouze v kyselině fluorovodíkové. Rozpouští se také v taveninách alkalických hydroxidů, ale nikoliv v jejich roztocích. Používá se na výrobu keramických nádob. Peroxid beryllnatý BeO2 není znám.
Byly popsány všechny čtyři halogenidy beryllnaté BeX2 (v pevné i plynné fázi). Ve vodě jsou rozpustné za současné hydrolýzy, krystalizací z vodného roztoku lze získat pouze chlorid beryllnatý jako tetrahydrát [Be(H2O)4]Cl2 (chlorid tetraaquaberyllnatý), který nelze termicky dehydratovat. Bezvodé halogenidy se připravují účinkem plynných halogenovodíků na beryllium.
Fluorid beryllnatý BeF2, který je možno získat i termickým rozkladem tetrafluoroberyllnatanu amonného (NH4)2[BeF4], je hygroskopická sklovitá látka vzhledem podobná tavenému křemeni.
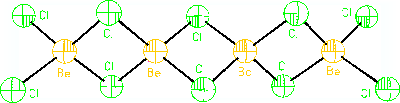
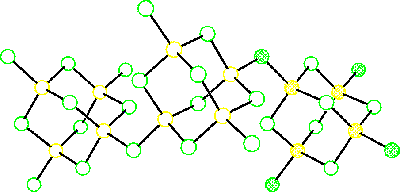
Amorfní produkt lze zahřátím (270 °C) převést na krystalickou formu. Byly připraveny ekvivalenty všech krystalových modifikací oxidu křemičitého. Deformovaná tetraedrická koordinace se uplatňuje i v řetězovitých polymerních makromolekulách chloridu beryllnatého BeCl2. Fluorokomplexy MI2BeF4, MI3Be2F7 a MIBeF3 se strukturně podobají křemičitanům, ve vodě se jen málo hydrolyzují. Chloroberyllnatany jsou nestálé, byly prokázány jen nepřímo.
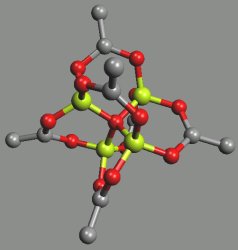
Amfoterní hydroxid beryllnatý Be(OH)2 se sráží z roztoků beryllnatých solí hydroxidy alkalických kovů až při překročení molárního poměru 1:1, a v roztoku je proto nutno předpokládat existenci polymerních iontů [Be(OH)]nn+. V nadbytku koncentrovaného roztoku hydroxidu alkalického kovu se získají roztoky tetrahydroxoberyllnatanů [Be(OH)4]2−. Hydrolýzou jejich tavenin opět vzniká hydroxid beryllnatý jako mikrokrystalická nebo rosolovitá amorfní látka. V prostředí benzenu tvoří hydroxid beryllnatý s karboxylovými kyselinami komplexy o složení Be4O(RCOO)6. Jsou to mimořádně stabilní látky tající a často i destilující bez rozkladu, rozpustné v nepolárních i některých polárních rozpouštědlech, v roztocích neionizující ani nepolymerující.
Termickým rozkladem dusičnanu beryllnatého vzniká, za uvolnění N2O4, strukturně analogický oxiddusičnan tetraberyllnatý Be4O(NO3)6.
Uhličitan beryllnatý BeCO3 existuje pouze jako tetrahydrát stálý jen v atmosféře oxidu uhličitého. Jsou známy i hydroxidouhličitany proměnlivého složení vznikající reakcí uhličitanů alkalických kovů s roztoky beryllnatých solí. Bezvodý síran beryllnatý BeSO4 má řetězovou polymerní strukturu a je ve vodě nerozpustný, zatímco jeho tetrahydrát je rozpustný velmi dobře.
Organoberyllnaté sloučeniny (látky obsahující vazbu Be-C) jsou, vzhledem ke schopnosti beryllia tvořit ochotně kovalentní vazby, známy ve značném počtu. Velmi reaktivní dialkylsloučeniny BeR2 lze získat reakcí LiR (R = alkyl) nebo Grignardových činidel (RMgX, R = alkyl, aryl; X = halogen) s chloridem beryllnatým v diethyletheru. Často je pro přípravu čistých sloučenin výhodnější použít reakce kovového beryllia s HgR2 (pro obtíže s odstraňováním diethyletheru). Dimethylberyllium (Be(CH3)2)n je řetězovitý polymer, v němž se uplatňují dvouelektronové třístředové vazby Be–C–Be. Objemné organické skupiny (But) poskytují monomerní produkty. Produkty reakcí (Be(CH3)2)n s nižšími alkoholy jsou polymerní alkoxidy (Be(OR)2)n. Jen formální obdobou ferrocenu je komplex bis(cyklopentadienyl)beryllnatý [Be(C5H5)2] (cyklopentadienylové kruhy v něm nejsou koplanární, diedrický úhel mezi nimi je v plynné fázi 117°; jeho strukturu lépe vystihuje vzorec ([Be(η1-C5H5)(η5-C5H5)]).