V zemské kůře je nejhojněji zastoupeno olovo (13 ppm, je známo ≈25 jeho minerálů), germanium (1,5 ppm) a cín (2,1 ppm) jsou vzácnější. Germanium je příměsí v jiných nerostech a v některých druzích uhlí. Nejvýznamnější rudou cínu je kassiterit SnO2, olova galenit PbS (zvětráváním galenitu vznikají sekundární minerály anglesit PbSO4 a cerusit PbCO3). Olovo je nejrozšířenějším těžkým kovem, protože tři ze čtyř jeho stabilních izotopů jsou konečnými produkty přirozených rozpadových řad. Všechny minerály cínu obsahují SnIV na rozdíl od olova, které se v přírodě vyskytuje výlučně jako PbII
Germanium je šedobílá, lesklá, velmi křehká látka krystalující v kubické soustavě (analog diamantu). Většina vlastností germania je na přechodu mezi vlastnostmi křemíku a cínu. Je polovodič, jeho elektrický odpor s teplotou klesá. Dopuje-li se germanium prvkem v oxidačním stupni +III (Ga) vede to ke vzniku polovodiče typu p, příměs prvku s oxidačním číslem +V (Sb) umožní vznik polovodiče typu n.
Cín je stříbrobílý měkký kov existující ve třech modifikacích
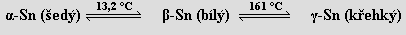

Nejstabilnější je tetragonální bílá β-modifikace, kubická α-modifikace má strukturu diamantu a existuje jen v mikrokrystalické formě (příčina cínového moru předmětů v muzeích skladovaných při teplotě nižší než 13 °C). Má deset v přírodě se vyskytujících izotopů (nejvíce ze všech prvků).
Olovo je měkký, nepříliš pevný, ale dobře kujný šedý kov s nádechem do modra. Je nejměkčí a nejtěžší z běžných kovů, není dobrým vodičem tepla ani elektřiny.

Všechny tři prvky uplatňují nejčastěji koordinační číslo čtyři v tetraedrickém uspořádání, možná je i oktaedrická koordinace (v SnO2 a PbO2 a v aniontech MX62−). Ionty M4+ se pro vysoké hodnoty ionizačních energií netvoří. Pevnost σ-vazeb MX v halogenidech MX4 klesá od germania k olovu. Tendence k tvorbě sloučenin MII ve stejném směru roste, elektronový pár ve valenčním s-orbitalu je stereochemicky aktivní. Germanium tvoří jen málo nestálých a snadno disproporcionujících sloučenin germanatých, sloučeniny cínaté jsou silnými redukovadly, sloučeniny olovičité silnými oxidovadly. Od germania k olovu se snižuje tendence k tvorbě vazeb kov-kov i pπ-dπ.
Reaktivita prvků ve skupině vzrůstá se zvyšující se atomovou hmotností. Germanium je reaktivnější než křemík, odolává však účinkům vzdušného kyslíku i vlhkosti, zředěným kyselinám i hydroxidům. Pomalu se rozpouští v horkých koncentrovaných kyselinách sírové a dusičné. V červeném žáru na vzduchu shoří na oxid germaničitý, tavením s alkalickými hydroxidy poskytuje germaničitany.
Bílá modifikace cínu odolává účinkům vzduchu, vody i zředěných roztoků kyselin a hydroxidů, zahřátím na vzduchu na 250 °C se oxiduje na oxid cíničitý. Je reaktivnější než germanium, ve vodných roztocích vykazuje výrazné amfoterní vlastnosti.
Reaktivita olova je snížena snadnou tvorbou ochranné vrstvičky jeho nerozpustných sloučenin (oxidu, síranu, uhličitanu), která ho chrání před další korozí. V přítomnosti kyslíku olovo reaguje s vodou a některými kyselinami za tvorby zásaditých solí. Vůči kyselinám se chová jako ušlechtilý kov v důsledku velkého přepětí vodíku.
Sklon hydridů k hydrolýze klesá v řadě SiH4 > SnH4 > GeH4. Bazicita oxidů roste od germania k olovu, redukční vlastnosti oxidů MO ve stejném směru klesají, oxidační schopnosti oxidů MO2 naopak rostou. Sloučeniny olovičité jsou v kyselém prostředí silnějšími oxidovadly než sloučeniny cíničité.
S Lewisovými bazemi tvoří halogenidy MX4 DA-komplexy typu MX4L2 (akceptorické schopnosti SnX4 klesají v řadě SnCl4 >> SnBr4 > SnI4), vratnou hydrolýzou poskytují rozpustné hydroxochlorokomplexy se stechiometrií [M(OH)nCl6-n]2−, Redukcí germania, cínu a olova sodíkem v kapalném amoniaku vznikají polyatomické anionty ([M4]2−, [M5]2−, [M9]2− a [M9]4−) stabilizovatelné velkými kationty ([Na(crypt)]+). Sloučeniny olova jsou silně toxické (inhibují řadu enzymů, otrava je spojena s nefritidou ledvin a poruchami centrálního nervového systému).
Germanium se vyrábí z popílku po spalování uhlí (v 1 tuně uhlí je obsaženo 20 až 70 gramů germania) nebo po výrobě zinku. Popílek se louží kyselinou sírovou a výluh se sráží roztokem hydroxidu sodného. Z koncentrátu obsahujícího dvě až deset procent germania se působení m směsi chlorovodíku s chlorem získá těkavý chlorid germaničitý, který se čistí destilací. Reakcí s vodou se pak převede na oxid germaničitý a ten se redukuje vodíkem. Nejčistší germanium se získává zonální tavbou. Cín se připravuje redukcí oxidu cíničitého uhlíkem
SnO2 + 2 C → Sn + 2 CO
Při výrobě olova z galenitu se nejprve flotací získává koncentrát, který se za omezeného přístupu vzduchu praží na oxid olovnatý a ten se po přídavku koksu a tavidla redukuje v šachtové peci
2 PbS + 3 O2 → 2 PbO + 2 SO2
PbO + C→ Pb + CO
Redukci uhlíkem lze nahradit redukcí pražené rudy dalším galenitem
2 PbO + PbS → 3 Pb + SO2
Srážecí metoda využívá redukce galenitu při vysoké teplotě železem
PbS + Fe → Pb + FeS
Cenné příměsi v olovu (měď, stříbro, zlato, zinek, cín, arsen, antimon) se získávají v průběhu jeho čištění.
Germanium nachází použití především v polovodičové technice. Cín se ve formě tenkých fólií používal pod názvem staniol v obalové technice a má význam pro povrchovou ochranu neušlechtilých kovů proti korozi (cínování železných plechů). Cín a olovo jsou součástí různých slitin (bronzy, pájky, liteřina, ložiskový kov) a používá se i řada jejich sloučenin (chlorid cíničitý k metalizováni skel a v bižuterii, oxid cíničitý do glazur a smaltů, oxid olovnatoolovičitý jako pigment do základních nátěrů na železo). Olovo se používá jako ochrana proti pronikavému záření a spolu s oxidem olovičitým je surovinou pro výrobu olověných akumulátorů (elektrolytem je ≈ 20% H2SO4 , napětí článku činí 2,04 V). Procesy probíhající na elektrodách vystihují rovnice
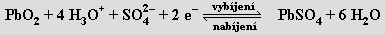
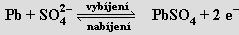
Celkově:
Pb + PbO2 + 2 H2SO4 ⇌ 2 PbSO4 + 2 H2O