Nejběžnější titaničitou sloučeninou je oxid titaničitý TiO2. Existuje ve třech polymorfních modifikacích (ve všech má titan koordinační číslo šest), z nichž nejstabilnější je rutil (tetragonální). Brookit (orthorhombický) a anatas (tetragonální) v něj zahříváním přecházejí. Krystalová struktura rutilu je typická pro mnoho sloučenin obecného vzorce MX2 (M = kov, X = O, F), je-li poměr poloměrů kationtu a aniontu rk/ra v intervalu 0,41–0,73 (při vyšších hodnotách tohoto poměru vzniká mřížka typu fluoridu vápenatého s koordinačním číslem osm). Rutil i anatas se používají jako stabilní nerozpustné bílé pigmenty, které se připravují hydrolýzou oxid-síranu nebo chloridu titaničitého
TiOSO4 + H2O → TiO2 + H2SO4
TiCl4 + 2 H2 O → TiO2 + 4 HCl
Titan tvoří podvojné oxidy typu spinelu Mg2TiO4, ilmenitu FeTiO3 a perowskitu CaTiO3. Směsné oxidy alkalických kovů a titanu vznikají tavením oxidu titaničitého s příslušnými oxidy, uhličitany nebo hydroxidy
TiO2 + 2 NaOH → Na2TiO3 + H2O
V roztoku se snadno hydrolyzují na hydratovaný oxid titaničitý rozpustný v kyselinách, jejich redukce vodíkem za vysoké teploty poskytuje chemicky inertní titanové bronzy NaxTiO2 (x = 0,2 až 0,25) s elektrickou vodivostí na úrovni kovů.
Ze sulfidů je nejdůležitější TiIVS2 (kovově lesklé polovodič).
Je známa úplná řada halogenidů titaničitých TiX4, jejichž barva se prohlubuje s rostoucím atomovým číslem halogenu (fluorid a chlorid jsou bezbarvé, bromid oranžový a jodid tmavohnědý). Netěkavý fluorid titaničitý TiF4 se připravují působením kyseliny fluorovodíkové na chlorid titaničitý. Chlorid titaničitý TiCl4 je bezbarvá, na vzduchu dýmající těkavá kapalina, která se připravuje zahříváním rutilu s uhlíkem v proudu chloru
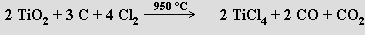
V kyselých roztocích hydrolyzuje na oxid-chlorid titaničitý TiOCl2. Chlorid titaničitý je meziproduktem při výrobě titanu i mnoha jeho průmyslově důležitých sloučenin (titanová běloba, chlorid titanitý).
Ve vodných roztocích lze v důsledku velké hodnoty poměru náboj/poloměr připravit pouze bazické titaničité soli silných oxokyselin. Monohydrát oxid-síranu titaničitého TiOSO4.H2O obsahuje klikaté řetězce -O-Ti-O-Ti-O-, kolem nichž jsou rozloženy anionty síranové a molekuly vody. Bezvodý dusičnan titaničitý Ti(NO3)4 se připravuje působením oxidu dusičného na TiCl4. Pro titaničité sloučeniny je charakteristická reakce jejich kyselých roztoků s peroxidem vodíku za tvorby intenzivně žlutě až červeně zbarvených peroxokomplexů obsahujících kationty [TiIV(H2O)x(O2)(OH)]+.
Modrý fluorid titanitý TiF3 lze připravit mnoha způsoby
2 Ti + 6 HF → 2 TiF3 + 3 H2
TiCl3 + 3 HF → TiF3 + 3 HCl
Ti + 3 TiF4→ 4 TiF3
Chlorid titanitý TiCl3 existuje v několika polymorfních modifikacích. Červenofialový α-TiCl3 je vrstevnatý polymer (s koordinačním číslem titanu šest), který se připravuje se redukcí chloridu titaničitého vodíkem
2 TiCl4 + H2→ 2 TiCl3 + 2 HCl
Hnědočerný β-TiCl3 je řetězovitý polymer (rovněž s koordinačním číslem titanu šest), v němž jsou atomy titanu pospojovány trojicemi chlorových můstků. Připravuje se redukcí chloridu titaničitého organokovovými sloučeninami (trimethylalanem). Ve vodě se rozpouští na fialový roztok obsahující ionty [Ti(H2O)6]3+, které jsou rovněž součástí pevných krystalohydrátů (titanitých kamenců MITi(SO4)2.12H2O, M = Rb, Cs).
Redukčních vlastností titanitých sloučenin se využívá v kvantitativní analýze (titanometrii) při odměrném stanovení sloučenin železitých, měďnatých a platičitých
[Fe(H2O)6]3+ + TiIII → [Fe(H2O)6]2+ + TiIV
[CuCl4]2– + TiIII → [CuCl2]– + TiIV + 2 Cl–
[PtCl6]2– + 2 TiIII → [PtCl4]2– + 2 TiIV + 2 Cl–
Obě modifikace chloridu titanitého (stejně jako modročerný bromid TiBr3 a fialověčerný jodid titanitý TiI3) se používají jako katalyzátory (Ziegler-Natta) při polymeracích nenasycených uhlovodíků (využívají se při výrobě polyethylenu, polypropylenu, polystyrenu, polybutadienu i polyisoprenu).
Obrázek 22.1. Mechanismus účinku Ziegler-Nattových katalyzátorů
Mechanismus účinku Ziegler-Nattových katalyzátorů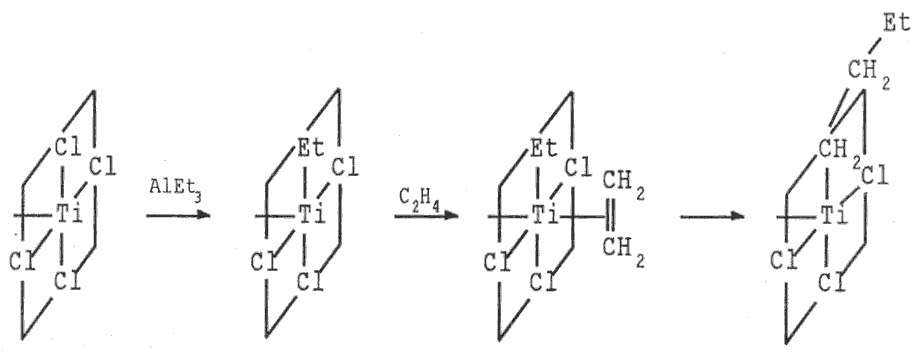
Fluorid titanatý TiF2 není schopen existence. Chlorid titanatý TiCl2 vzniká jako černý pyroforický prášek reakcí
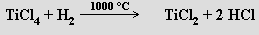
nebo výhodněji disproporcionací komplexu TiCl3 s tetrahydrofuranem (THF)
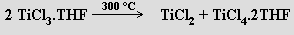
Velmi snadno disproporcionuje
2 TiCl2 → TiCl4 + Ti
a je proto obtížné ho připravit v čisté formě.