Roztoky
Roztok je homogenní směs dvou nebo více látek (solutů). Roztoky mohou být plynné (např. vzduch), kapalné nebo pevné (slitiny kovů). V lidském organismu se vyskytují roztoky kapalné, v nichž rozpouštědlem je voda. Rozpouštědlo (solvent) je složka roztoku, která v roztoku převládá. Složení roztoků lze vyjádřit několika způsoby. Zde uvádíme ty nejběžnější, a zde jsou uvedeny další možnosti vyjádření koncentrace. Látková koncentrace (molární koncentrace, molarita) cB udává látkové množství rozpuštěné látky B (nB) v jednotkovém objemu roztoku (V), tedy počet molů rozpuštěné látky v 1 litru roztoku (mol.l-1, zkráceně také M).Hmotnostní zlomek se často vyjadřuje v hmotnostních procentech, kdy údaj udává hmotnost látky v gramech, které jsou rozpuštěny ve 100 g roztoku (hmotn. %).
wB = 100 wB % = 1000 wB ‰ = 1 000 000 wB ppm
Vzorové příklady
Kolik gramů NaOH je potřeba na přípravu 250
ml roztoku o koncentraci 0,1 mol/l? Mr(NaOH) = 40.
Řešení: Nejprve vypočítáme látkové množství NaOH potřebné na přípravu roztoku.
Potom převedeme látkové množství na hmotnost NaOH.
n(NaOH) = c (NaOH) . V(roztoku) = 0,1 mol.l-1.
m(NaOH) = n(NaOH) . M(NaOH) = 0,025 mol
.
Kolik gramů NaCl a kolik gramů vody je
potřeba na přípravu
Řešení: Použijeme vztah pro výpočet hmotnostního zlomku.
w(NaCl) = m(NaCl) / m(roztoku) Þ
m(NaCl) = w(NaCl) . m(roztoku) =
0,009 .
Hmotnost vody se vypočte z hmotnostního
zlomku vody v roztoku. Pro kontrolu, součet hmotnosti obou složek musí být
roven hmotnosti celého roztoku.
w(H2O) = 1 - w(NaCl) = 1 - 0,009 =
0,991
m(H2O) = w(H2O) . m(roztoku) = 0,991 .
Koncentrace glukosy v krvi je 5 mmol.l-1.
Jaká je hmotnostní koncentrace glukosy? Mr(glukosy) = 180.
Řešení: Vypočteme hmotnost 5 mmol glukosy v jednom litru krve.
n(glc) = m(glc) / M(glc) => m(glc) = n(glc) . M(glc) = 0,005
mol .
Hmotnostní koncentrace je tedy
Elektrolyty a neelektrolyty
Chování nízkomolekulových látek při rozpouštění ve vodě. Při rozpouštění dochází k rozptylu částic rozpouštěné látky v rozpouštědle. Přitom se přerušují síly, které udržují částice v organizovaném pevném/kapalném stavu, a dochází k solvataci rozpuštěných částic. Například při rozpouštění pevné látky "vytrhávají" molekuly rozpouštědla vlivem přitažlivých sil a tepelného pohybu molekuly nebo ionty rozpouštěné látky z krystalové struktury a obklopují je opačně nabitými konci – solvatují je (ve vodě hydratují).
Síly působící mezi molekulami rozpouštědla a částicemi rozpouštěné látky závisí na jejich chemické povaze, jedná se o slabé nevazebné interakce. U nepolárních, příp. málo polárních látek a rozpouštědel, to bývají síly van der Waalsovy, u polárnějších se mohou uplatňovat vodíkové můstky. Iontové sloučeniny se nejlépe rozpouštějí v polárních rozpouštědlech (voda), kde se uplatňují elektrostatické interakce ion-dipól.
Při rozpouštění polárních látek ve vodě nebo jiných polárních rozpouštědlech dochází účinkem rozpouštědla k disociaci sloučeniny na ionty. Látky, které se v roztoku štěpí na ionty, se nazývají elektrolyty. Jejich vodné roztoky nebo taveniny vedou elektrický proud. Proces štěpení se označuje jako elektrolytická disociace. Ionty vzniklé disociací jsou v roztoku obalené (solvatované) molekulami rozpouštědla, které tvoří tzv. solvatační obal iontu. V případě, že je rozpouštědlem voda, hovoříme o hydratačním obalu. Látky, jejichž molekuly při rozpouštění ve vodě zůstávají zachovány a neštěpí se, se označují neelektrolyty. Neelektrolyty jsou málo polární nebo nepolární kovalentní sloučeniny (např. glukosa, močovina, ethanol, glycerol). Jejich roztoky nevedou elektrický proud.

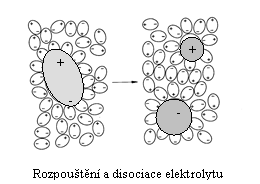 Roztoky elektrolytů. Mezi
elektrolyty patří sloučeniny
iontového charakteru (např. NaCl, KOH) nebo látky, v jejichž molekulách se
nachází velmi polární kovalentní vazba (např. HCl, HNO3, CH3COOH).
Účinkem polárního rozpouštědla se tyto látky štěpí na ionty. Podle stupně
disociace rozdělujeme elektrolyty na slabé
a silné.
Roztoky elektrolytů. Mezi
elektrolyty patří sloučeniny
iontového charakteru (např. NaCl, KOH) nebo látky, v jejichž molekulách se
nachází velmi polární kovalentní vazba (např. HCl, HNO3, CH3COOH).
Účinkem polárního rozpouštědla se tyto látky štěpí na ionty. Podle stupně
disociace rozdělujeme elektrolyty na slabé
a silné.
V případě slabých elektrolytů dochází k disociaci sloučenin pouze částečně a v roztoku se ustavuje rovnováha mezi neionizovanými molekulami a vzniklými ionty. Mezi slabé elektrolyty patří slabé kyseliny (např. kys. dusitá, octová, mléčná, uhličitá) a slabé zásady (např. amoniak). Slabé elektrolyty se liší mírou ionizace, která je charakterizována pomocí disociační konstanty.
Silné elektrolyty jsou v roztocích prakticky úplně ionizované, kromě vody obsahují pouze hydratované kationty a anionty. Mezi silné elektrolyty patří prakticky všechny soli (např. NaCl, MgCl2, K2SO4), dále silné kyseliny (např. HCl, HNO3, H2SO4) a silné hydroxidy (např. NaOH, KOH, Ca(OH)2).
Elektrolytická disociace ovlivňuje podstatně vlastnosti roztoků – má vliv např. na pH roztoků, osmotický tlak, vodivost atd.
Pro pochopení podstaty vlastností silných elektrolytů je zásadní porozumění následujícím úvahám:- V jednom litru roztoku HCl o koncentraci 0,1 mol/l se nachází 0,1 mol iontů H+, 0,1 mol iontů Cl- a žádné nedisociované molekuly HCl. (HCl → H+ + Cl-)
- V jednom litru roztoku MgCl2 o koncentraci 0,1 mol/l se nachází 0,1 mol Mg2+ a 0,2 mol Cl- a žádné molekuly MgCl2. (MgCl2 → Mg2+ + 2 Cl-)
- V jednom litru roztoku Ca(OH)2 o koncentraci 0,1 mol/l se nachází 0,1 mol iontů Ca2+, 0,2 mol iontů OH- a žádné molekuly Ca(OH)2. (Ca(OH)2 → Ca2+ + 2 OH-)
Obecné vlastnosti neelektrolytů a elektrolytů jsou shrnuty v následující tabulce:
|
Charakteristika |
Neelektrolyt |
Slabý elektrolyt |
Silný elektrolyt |
|
Typ částic
v roztoku Rovnováha
v roztoku Míra
disociace Příklad |
Molekuly Ne Žádná Glukosa |
Molekuly + ionty Ano Částečná H2CO3 |
Ionty Ne Úplná NaCl |
Osmotický tlak
Osmotický tlak je důležitou vlastností všech roztoků. Existenci osmotického tlaku lze demonstrovat na následujícím pokusu:
Čisté rozpouštědlo a roztok látky v něm rozpuštěné se oddělí tzv. semipermeabilní membránou. Tato membrána bude propouštět pouze molekuly rozpouštědla a ne molekuly rozpuštěné látky. Pokud by membrána nebyla přítomna, bude docházet k samovolné difuzi molekul rozpuštěné látky do místa s nižší koncentrací. Poněvadž membrána difuzi rozpuštěné látky zabraňuje a propouští jen molekuly rozpouštědla, začnou molekuly rozpouštědla pronikat do roztoku (s tendencí zřeďovat roztok). Roztok látky se bude postupně zřeďovat a zvětšovat svůj objem. Tomuto samovolnému zřeďování roztoku pronikáním molekul rozpouštědla přes semipermeabilní membránu říkáme osmóza. Tlak, který bychom museli vyvinout na roztok, abychom zamezili difůzi molekul rozpouštědla semipermeabilní membránou, označujeme jako osmotický tlak (Π).
- Nerovnovážný stav Rovnováha

čisté rozpouštědlo roztok c1 čisté rozpouštědlo roztok c2
Známe-li látkovou koncentraci roztoku, lze hodnotu osmotického tlaku pro zředěné roztoky přibližně vypočítat podle vztahu:
Π = i.c. R.T (kPa)
kde i je počet částic vzniklých disociací z jedné molekuly rozpuštěné látky, c je látková koncentrace roztoku (mol.l-1), R je univerzální plynová konstanta (8,341 J.mol-1.K-1) a T je absolutní teplota (K). Je-li rozpuštěná látka neionizovaná (neelektrolyt), i = 1. Jestliže rozpuštěná látka ionizuje, pak ve velmi zředěných roztocích je každý ion osmoticky aktivní částicí, pro silný elektrolyt je tedy i = 2, 3, … atd. Z uvedeného vyplývá, že velikost osmotického tlaku roztoku závisí nejen na koncentraci roztoku, ale na tom, zda rozpuštěná látka je elektrolytem či nikoliv. Součin i.c vyjadřuje osmolaritu roztoku.
Vzorový příklad
Srovnejme velikost osmotického tlaku roztoků NaCl a glukosy, které mají shodnou koncentraci c = 154 mmol/l:
Protože NaCl je silným elektrolytem, disociuje dle rovnice NaCl → Na+ + Cl-,
tedy poskytuje při disociaci dvě částice. Hodnota i = 2, osmolarita je tedy 2 . 154 = 308 mmol/l.
Glukosa je neelektrolyt, v roztoku se neštěpí, i = 1, proto osmolarita je 1 . 154 = 154 mmol/l.
Z uvedeného vyplývá, že přestože oba roztoky mají stejnou koncentraci, osmolarita a tedy i osmotický tlak roztoku NaCl je dvakrát větší.
V praxi se osmotický tlak zjišťuje měřením pomocí osmometrů, naměřené hodnoty se vyjadřují v mmol/kg H2O (osmolalita).
Vzorový příklad
Vyberte roztok, který má nejvyšší osmolaritu.
a) roztok sacharosy o koncentraci c=0,3 mol/l
b) roztok Na3PO4 o koncentraci c=0,1 mol/l
Řešení:
Glukosa je neelektrolyt, v roztoku se neštěpí na ionty, i = 1, proto osmolarita je 1 . 0,3 mol/l = 0,3 mmol/l.
Na3PO4 je elektrolyt, v roztoku disociuje na ionty podle rovnice: Na3PO4 → 3 Na+ + PO43-, 1 mol Na3PO4 disociuje na 4 moly iontů, proto osmolarita je 4 . 0,1 mol/l = 0,4 mmol/l.
Vyšší osmolaritu má tedy roztok Na3PO4.
Osmolalita krevní plazmy (séra)
Osmolalita krevního séra u zdravých lidí má rozpětí 280–295 mmol.kg-1 H2O, osmolalita roztoku NaCl izotonického s krevním sérem je kolem 290 mmol.kg-1 H2O.
V klinické praxi se osmolalita krevní plazmy rovněž odhaduje z látkových koncentrací (mmol.l-1) hlavních součástí plazmy. Existuje celá řada empirických vztahů, např.:
osmolalita plazmy (mmol.kg-1 H2O) ≈ 2 [Na+] + [glukosa] + [močovina]
Hodnota změřená osmometrem a vypočtená hodnota se běžně shodují, resp. liší se pouze v intervalu do 5, maximálně 10 mmol/kg H2O. Porovnání výpočtu s měřením je užitečné tam, kde je podezření na přítomnost látek o malé molekule, s nimiž empirický výpočet nepočítá. Měření potom může být vyšší než výpočet třeba až o 50 až 100 mmol/kg H2O. Hovoříme potom o osmolárním gapu. Např. 1 promile alkoholu v plazmě zvýší naměřenou osmolalitu o cca 23 mmol/kg H2O.
Na osmotickém tlaku krevní plazmy se podílejí malým podílem (~ 0,5 % z celkového tlaku) molekuly proteinů, především albuminu. Kapilární stěna, která odděluje plazmu od intersticiální tekutin se chová jako semipermeabilní membrána (je nepropustná pro proteiny, propustná pro vodu a nízkomolekulární látky), což se projevuje tzv. koloidně-osmotickým (onkotickým) tlakem. Onkotický tlak má velký význam pro přesuny vody mezi krví a extracelulárním prostředím v živých organismech. Uniká-li voda z kapilár, zvyšuje se v lumen kapilár onkotický tlak a působí tak proti dalšímu výstupu vody z kapilár. Při snížené hladině bílkovin v krvi pak dochází k přesunům vody do intersticia v důsledku snížení onkotického tlaku a vznikají otoky.
Dva roztoky, které mají stejný osmotický tlak se označují jako
izotonické (izoosmotické); roztok, jehož
osmotický tlak je nižší ve srovnání s jiným označujeme jako hypotonický a roztok s vyšším
osmotickým tlakem jako hypertonický.
V lékařství se izotonickými roztoky obvykle míní roztoky se stejným
osmotickým tlakem jako má krevní plazma, např. 0,9 % roztok NaCl (
Změny osmotického tlaku prostředí vedou ke změnám objemu a tvaru buněk. Buňky v hypotonickém prostředí přijímají vodu z okolí a zvětšují svůj objem. V hypotonickém prostředí dochází porušení až rozpadu membrán erytrocytů (hemolýza), ze kterých se uvolňuje červené krevní barvivo hemoglobin. Hypertonické prostředí vede k osmóze opačným směrem, jejímž výsledkem je svrašťování buněk. Biologické membrány nejsou polopropustné v pravém slova smyslu, protože jimi pronikají kromě vody i mnohé rozpuštěné látky. Jako roztoky izotonické s biologickými tekutinami lze použít pouze ty, jejichž soluty nepronikají z roztoku do buněk (většinou se jedná o roztoky elektrolytů). Jako izotonické tedy nemohou být použity roztoky obsahující látku snadno procházející buněčnými membránami (např. močovinu), protože tyto roztoky se v přítomnosti buněk postupně stávají hypotonickými.
Osmotický tlak má velký význam pro přesuny vody v organismu. Např. v tenkém střevě dochází k transportu sodných iontů z lumen přes vrstvu epitelových buněk. Tím vzniká osmotický gradient, který vyvolává současný přesun molekul vody. Obdobně dochází k resorpci vody v proximálním tubulu ledvin. Rovněž polyurii při diabetu lze vysvětlit na základě osmózy. Při této chorobě je zvýšená koncentrace glukosy v krvi a při filtraci v glomerulech se glukosa dostává do primární moči. V tubulech se nestačí resorbovat, její koncentrace v moči zůstává vysoká a současně osmoticky poutá vodu. Terapie mannitolem při mozkových edémech, intoxikacích nebo zvýšeném nitroočním tlaku je založena taktéž na tomto principu. Mannitol působí jako osmotické diuretikum (po intravenózním podání se filtruje v ledvinách, nevstřebává se a osmoticky poutá vodu).
Literatura:
Jiří Dostál, Hana Paulová, Jiří Slanina, Eva Táborská: Biochemie pro posluchače bakalářských oborů (Brno, 2009).

Copyright © 2011, Biochemický ústav, Lékařská fakulta, Masarykova univerzita
Správce stránky: jrslanina(zavináč)med(tečka)muni(tečka)cz
Stránky vznikly s podporou FOND ROZVOJE VYSOKÝCH ŠKOL, projekt č. 2482/2011