2.4.2 Názvy aniontů
Anionty jsou ionty nesoucí záporný elektrický náboj.
a) Jednoatomové a některé víceatomové anionty
Názvy těchto aniontů v solích nesou zakončení „-id“, názvy samostatných aniontů jsou tvořeny slovem „anion“ (resp. „ion“) a nesou zakončení „-idový“.
Příklady:
| H- | anion hydridový | NH2– | anion amidový |
| D- | anion deuteridový | NH2– | anion imidový |
| F- | anion fluoridový | N3– | anion nitridový |
| Cl- | anion chloridový | N3– | anion azidový |
| Br- | anion bromidový | N2H3– | anion hydrazidový |
| I– | anion jodidový | P3– | anion fosfidový |
| I3– | anion trijodidový | Sb3– | anion antimonidový |
| O2– | anion oxidový | C22– | anion acetylidový |
| O22– | anion peroxidový | C4– | anion karbidový |
| O2– | anion hyperoxidový | Si4– | anion silicidový |
| O3- | anion ozonidový | CN– | anion kyanidový |
| OH– | anion hydroxidový | SCN– | anion thiokyanatanový (rhodanidový) |
| S2– | anion sulfidový | OCN– | anion kyanatanový |
| S22– | anion disulfidový | NCS– | anion isothiokyanatanový |
| HS– | anion hydrogensulfidový | NCO– | anion isokyanatanový |
| Se2– | anion selenidový | B3– | anion boridový |
| Te2– | anion telluridový |
b) Anionty odvozené od kyslíkatých kyselin
Jejich názvy vycházejí z českého názvu centrálního atomu a nesou zakončení podle oxidačního čísla tohoto atomu.
Názvoslovná zakončení pro anionty kyslíkatých kyselin se odvozují od názvoslovných zakončení pro kationty (-ný, -natý, -itý, …) tak, že se koncové „ý“ nahradí koncovkou „-an“. Jedinou výjimkou je posun „ový“ → „an“ (viz tabulka IX).
Příklad:
| SO32– | anion siřičitanový, siřičitan |
| ale | |
| SO42– | anion síranový (nikoliv sírovanový), resp. síran (nikoliv sírovan) |
V případě samostatného iontu se před název přidá podstatné jméno „anion“ (resp. „ion“) a za názvoslovné zakončení se přidá koncovka „-ový“.
Tabulka IX: Názvy aniontů odvozených od oxokyselin
| oxidační číslo centrálního atomu | zakončení pro kation | zakončení pro anion kyslíkaté soli | příklad aniontu | název aniontu v soli |
název samostatného aniontu |
| I | -ný | -nan | ClO– | chlornan | anion chlornanový |
| II | -natý | -natan | MnO22– | manganatan | anion manganatanový |
| III | -itý | -itan | NO2– BO33– |
dusitan boritan |
anion dusitanový anion boritanový |
| IV | -ičitý | -ičitan | SO32– | siřičitan | anion siřičitanový |
| V | -ičný -ečný |
-ičnan -ečnan |
NO3– ClO3– PO43– |
dusičnan chlorečnan fosforečnan |
anion dusičnanový anion chlorečnanový anion fosforečnanový |
| VI | -ový | -an | SO42– | síran | anion síranový |
| VII | -istý | -istan | MnO4– | manganistan | anion manganistanový |
| VIII | -ičelý | -ičelan | OsO52– | osmičelan | anion osmičelanový |
Pozn.: Názvy aniontů lze odvodit od názvů příslušných kyselin takto:
- „kyselina“ → „ion“, resp. „anion“
- koncové „-á“ (v případě oxidačního čísla VI „-ová“) → „-anový“
- údaj o počtu atomů H → údaj o celkovém záporném náboji aniontu:
| H2SO4 | kyselina sírová | SO42– | anion síranový |
| H5P3O10 | kyselina katena-pentahydrogentrifosforečná | P3O105– | anion katena-trifosforečnanový(5–) |
| H2OsO5 | kyselina osmičelá | OsO52- | anion osmičelanový |
| H6W6O21 | kyselina hexahydrogenhexawolframová | W6O216– | anion hexawolframanový(6–) |
c) Polyanionty odvozené od kyslíkatých kyselin
Polyanionty jsou anionty, obsahující více než jeden centrální atom. Pokud jsou všechny centrální atomy představovány jedním prvkem, mluvíme o izopolyaniontech, pokud jsou představovány alespoň dvěma prvky, mluvíme o heteropolyaniontech.
U obou typů polyaniontů shodně rozlišujeme dva strukturní typy – uspořádání cyklické a řetězcovité (necyklické).
Odlišení cyklických a řetězcovitých struktur
Pro cyklickou strukturu se používá označení „cyklo-“ (včetně pomlčky), pro necyklickou strukturu označení „katena-“. Při stejných oxidačních číslech centrálních atomů se tyto dvě struktury liší nejen tvarem molekul, ale i počtem atomů kyslíku a nábojem:
 |
 |
| anion katena-trifosforečnanový(5–) | anion cyklo-trifosforečnanový(3–) |
| P3O105- | P3O93- |
Pozn.: Z označení struktury cyklo (resp. katena) plyne (při udání oxidačních čísel centrálních atomů) celkový náboj polyaniontu a naopak z celkového náboje polyaniontu a oxidačních čísel centrálních atomů vyplývá typ struktury (cyklo, katena). V názvu tedy nemusíme (ale můžeme) uvádět obě informace.
A) Izopolyanionty
jako centrální atomy obsahují jeden prvek. Jednotlivé centrální atomy se však dále mohou (ale nemusí) lišit svým oxidačním číslem. Oba případy budou rozebrány odděleně:
Izopolyanionty se stejnými oxidačními čísly centrálních atomů
Tvorba názvu ze vzorce:
Jednoduchá číslovková předpona udává počet centrálních atomů, názvoslovná koncovka udává jejich oxidační číslo a pomocí Ewens-Bassettova čísla se vyznačí celkový náboj polyaniontu. Počet kyslíkových atomů není nutno uvádět.
Příklady:
| Si2O76- | anion dikřemičitanový(6–) |
| P3O105- | anion trifosforečnanový(5–) |
| W6O216- | anion hexawolframanový(6–) |
V názvu soli nebo kyseliny obsahující izopolyanion je možno místo Ewens-Bassettova čísla udat počet kationtů.
Příklady:
| K6Si2O7 | dikřemičitan hexadraselný nebo dikřemičitan(6–) draselný |
| Na5P3O10 | trifosforečnan pentasodný nebo trifosforečnan(5–) sodný |
| H6W6O21 | kyselina hexahydrogenwolframová |
Tvorba vzorce z názvu:
Při tvorbě vzorce z názvu je třeba se řídit udanými počty atomů, skupin a oxidačními čísly. Problém nastává, není-li v názvu uvedeno Ewens-Bassettovo číslo ani počet kationtů ani počet atomů kyslíku, např.: „dichroman draselný“. V tomto případě bez dalších informací nelze vzorec sestavit. Počet atomů kyslíku však lze určit na základě znalosti struktury polyaniontů kyslíkatých kyselin. Počty jednotlivých druhů atomů vyplynou ze strukturního vzorce:
Příklad:

Z uvedeného strukturního vzorce je zjevné, že molekulový vzorec dichromanu draselného bude K2Cr2O7.
Izopolyanionty s různými oxidačními čísly centrálních atomů
Tvorba názvu ze vzorce:
Jednoduchou číslovkovou předponou se vyjádří počet centrálních atomů s daným oxidačním číslem, názvoslovnou koncovkou se udá jejich oxidační číslo a pomocí Ewens-Bassettova čísla se vyznačí celkový náboj polyaniontu. Počet kyslíkových atomů není nutno uvádět. Názvy jednotlivých složek (kromě poslední) nesou koncovku „o“ a jsou navzájem propojeny pomlčkami, takže název celého aniontu je tvořen jedním slovem.
Příklad:
| (Mo2VMo4VIO18)2- | anion dimolybdeničnano-tetramolybdenanový(2–) |
V názvu soli nebo kyseliny obsahující izopolyanion je možno místo Ewens-Bassettova čísla udat počet kationtů.
Příklad:
| Na2(Mo2VMo4VIO18) | dimolybdeničnano-tetramolybdenan(2–) sodný nebo dimolybdeničnano-tetramolybdenan disodný |
Tvorba vzorce z názvu:
Řídíme se udanými počty atomů, skupin a oxidačními čísly.
B) Heteropolyanionty
Jako centrální atomy obsahují nejméně dva různé prvky. Při tvorbě názvu se každá složka pojmenovává zvlášť (pojmenování centrálního atomu a udání jeho oxidačního čísla názvoslovným zakončením). Názvy jednotlivých složek (kromě poslední) nesou koncovku „o“ a jsou navzájem propojeny pomlčkami, takže název celého aniontu je tvořen jedním slovem.
Řazení složek v názvu:
- Není-li známa struktura, řadí se jednotlivé složky abecedně (podle značek centrálních atomů).
- Je-li známa struktura, uvádějí se složky za sebou tak, jak jsou vázány, přičemž se začíná od té krajní složky, jejíž značka centrálního atomu je v abecedě dříve.
Pozn.:
- Nejsou-li u centrálních atomů zapsána Stockova čísla, může být převod vzorce na název nejednoznačný. Proto je lépe oxidační čísla (= Stockova čísla) ve vzorci vyznačit římskými čísly.
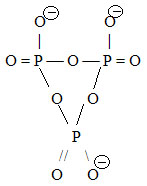
Příklady:
| anion katena-chromano-arseničnano-fosforečnanový(4–) | |
| Pozn.: Název začíná od Cr, neboť C je v abecedě dříve než P. | |
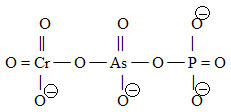 |
- strukturní vzorec |
| (O3CrVIOAsVO2OPVO3)4- | – funkční vzorec |
| (CrVIAsVPVO10)4- | – molekulový vzorec |
| anion cyklo-arseničnano-chromano-sírano-fosforečnanový(2–) | |
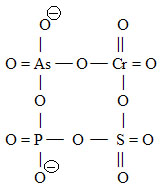 |
- strukturní vzorec |
| (OAsVO2OCrVIO2OSVIO2OPVO2)2- | – funkční vzorec |
| (AsVCrVISVIPVO12)2- | – molekulový vzorec |
- Při pojmenování kyselin se slovo „hydrogen“ (označující spolu s číslovkovou předponou počet atomů vodíku vázaných v molekule kyseliny) od názvu aniontu neodděluje.
- Z počtu kationtů a jejich oxidačních čísel vyplývá náboj polyaniontu automaticky, nemusí se tedy v názvu soli nebo kyseliny uvádět (uvedeme-li počty a oxidační čísla kationtů).
Příklady:
| H4(O3CrVIOAsVO2OPVO3) | kyselina tetrahydrogenchromano-arseničnano-fosforečná |
| (NH4)6(Mo6TeO24) · 7 H2O | heptahydrát hexamolybdenano-telluranu hexaamonného |
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
