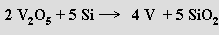
Vanad je na Zemi dosti rozšířeným prvkem (136 ppm). Vyskytuje se ve více než šedesáti minerálech (patronit VS4, vanadinit 3Pb3(VO4)2.PbCl2, karnotit K(UO2)VO4.3/2H2O) a je obsažen také v ropě. Je biogenním prvkem (zajímavá je schopnost některých bezobratlých mořských živočichů kumulovat vanad v krvi na koncentraci 106 až 107× vyšší než je v mořské vodě, v níž žijí). Niob (20 ppm) a tantal (1,7 ppm) patří k poměrně vzácným prvkům. Jsou obsaženy v minerálu proměnlivého složení (Fe,Mn)[(Nb,Ta)O3]2, který se při větším obsahu niobu než tantalu nazývá kolumbit, v opačném případě tantalit.
Vanad, niob i tantal jsou stříbrolesklé kovy s vysokými body tání (vanad má nejvyšší bod tání z prvků první přechodné řady). Všechny krystalují v prostorově centrovaných kubických mřížkách. Čisté kovy jsou relativně měkké, tvrdost a křehkost způsobuje přítomnost nečistot. Velmi malý rozdíl v hodnotách inotových poloměrů niobu a tantalu (důsledek lanthanoidové kontrakce) způsobuje blízkoou příbuznost analogických sloučenin těchto prvků. Důsledkem malého kovového poloměru tantalu je vysoká hustota (16,65 g.cm-3, niob pouze 8,57 g.cm-3) tohoto prvku.
Nejvyšším oxidačním stupněm všech tří prvků je +V , možné jsou všechny nižší hodnoty až po -I. Stabilita nejvyššího oxidačního stavu roste s atomovým číslem prvku. U vanadu jsou za běžných podmínek nejstálejší sloučeniny VIV (ion vanadylový (2+) VO2+ je považován za nejstabilnější víceatomový kation), zatímco sloučeniny VIII a VII mají redukční vlastnosti. Chemie niobu a tantalu je převážně omezena na oxidační stav +V. Pouze vanadičnany, niobičnany a tantaličnany jsou diamagnetické a převážně bezbarvé, sloučeniny s nižšími oxidačními stavy kovů jsou paramagnetické a rozmanitě zbarvené. Vyšší oxidační stavy jsou stabilizovány elektronegativními ligandy (fluor stabilizuje u vanadu oxidační stupně +V a +IV, zatí mco jodidy jsou známy jen pro oxidační stavy +II a +III), nižší stavy π-donorovými ligandy. Vazby ve sloučeninách jsou více či méně polární (v důsledku menších ionizačních energií a většího objemu hypotetických iontů Ta5+ a Nb5+ jsou vazby těchto prvků polárnější než odpovídající vazby vanadu). S klesajícím oxidačním stupněm kovu roste iontový charakter vazeb. V oxidačních stavech +II a +III jsou známy soli kationtů Vn+ (modrofialové kamence MIVIII(SO4)2.12H2O) a také koordinační chemie je omezena pouze na vanad.
Všechny tři prvky 5. skupiny se snadno pasivují a v kompaktní formě jsou odolné vůči působení většiny kyselin s výjimkou kyseliny fluorovodíkové (vanad se za horka rozpouští i v silně oxidujících kyselinách) i tavenin alkalických hydroxidů (s výjimkou tantalu). Za zvýšené teploty v kyslíku shoří na oxidy M2O5 (M = V, Nb, Ta), s uhlíkem, borem a dusíkem tvoří intersticiální sloučeniny (tvrdé, obtížně tavitelné látky s vysokou elektrickou vodivostí). U vanadu exisuje rozsáhlá chemie polyvanadičnanů. Podobnost s prvky 15. skupiny je jen formální a pouze v nejvyšším oxidačním stavu +V.
Příprava vanadu je několikastupňový proces. Pražením rudy s uhličitanem nebo s chloridem sodným (850 °C) vzniká metavanadičnan sodný NaVO3, který se z taveniny vyluhuje vodou. Okyselením výluhu na pH 2 až 3 kyselinou sírovou se získá červený koláč polyvanadičnanů, které tavením (700 °C) převedou na oxid vanadičný. Ferrovanad obsahující 35 až 95 % vanadu se průmyslově získává redukcí oxidu vanadičného ferrosiliciem v elektrické peci
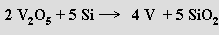
Odpadní oxid křemičitý se přísadou oxidu vápenatého převede do strusky
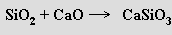
Čistý vanad je obtížné připravit pro jeho reaktivitu při vysokých teplotách, kdy se kromě s kyslíkem a dusíkem slučuje i s uhlíkem (na karbid V4C3; nelze proto použít redukce koksem) a vodíkem, jejichž obsah zvyšuje křehkost kovu. Van Arkel - de Boerova metoda čistění kovu není pro vanad příliš vhodná pro malou těkavost jodidu vanadnaté ho
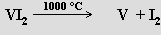
Oddělování niobu od tantalu je pracné a v současné době se k tomuto účelu používají extrakční metody. Konečnými produkty klasického postupu jsou rozpustný K2NbOF5 a málo rozpustný K2TaF7. Z K2NbOF5 (nebo Nb2O5) se niob připraví aluminotermicky, tantal se z K2TaF7 získá elektrolýzou taveniny.
Ferrovanad se používá k výrobě slitin a k odstraňování kyslíku a dusíku při výrobě oceli (karbid V4C3 zjemňuje zrnitou strukturu pružinových a rychlořezných ocelí). Niob je součástí nerezavějících ocelí, tantal je pro svou chemickou odolnost používán k výrobě reakčních nádob v chemickém průmyslu, v elektrotechnice pro výrobu kondenzátorů (vrstva oxidu slouží jako účinný izolant) a také jako kostní náhrada v chirurgii (umožňuje to jeho naprostá stálost vůči tělním tekutinám).