
Uhlík je znám už velmi dlouho (jako dřevěné uhlí a saze; použití sazí na výrobu inkoustu bylo známo už ve starém Egyptě), ale jako prvek byl rozpoznán až v 18. století. Historii poznání uhlíku a jeho sloučenin může dokumentovat několik následujících dat
| 1273 | v Londýně bylo zakázáno používání uhlí jako zdraví škodlivého |
| 1564 | grafit byl použit v tužkách |
| 1752 | byl charakterizován oxid uhličitý jako první plyn jiný než vzduch |
| 1779 | objev fotosyntézy |
| 1789 | pro prvek byl zaveden název carbon (carbo = dřevěné uhlí) |
| 1796 | diamant byl rozpoznán jako modifikace uhlí ku |
| 1807 | bylo zavedeno rozdělení sloučenin na anorganické a organické |
| 1955 | realizace výroby průmyslových diamantů |
| 1985 | ohlášen objev fullerenů |
Přírodní uhlík se skládá z 98,89 % 12C, 1,11 % 13C a stop radioaktivního 14C, který vzniká v horních vrstvách atmosféry reakcí 147N (n,p)146C a rozpadá se s poločasem 5715 ± 50 let za emise elektronu. Poskytuje možnost určení stáří reliktů rostlin nebo živočichů (do 50 000 let). Četností výskytu v zemské kůře je až 17. prvkem (180 ppm). Spolu s vodíkem je základní složkou živých organismů. V přírodě existují cykly v koloběhu uhlíku v mořích a na pevnině a spojení mezi nimi je zajištěno atmosférou. V důsledku stále intenzivnější technologické činnosti lidstva exponenciálně stoupá produkce oxidu uhličitého, což může mít za následek vážné narušení rovnovážného stavu v těchto systémech (zvyšující se obsah CO2 v atmosféře může způsobit skleníkový efekt spojený se zvyšováním průměrné teploty na Zemi, změnou pH moří se ovlivní i rozpustnost některých minerálů).
Uhlík je obsažen v litosféře, hydrosféře i atmosféře. Je popsáno nejméně šest (bez započtení fullerenů) dobře definovaných alotropických modifikací, z nichž nejvýznamnější jsou diamant a grafit. Oba se vedle velkého množství anorganických i organických sloučenin nacházejí v přírodě (největší přírodní diamant nazvaný Cullinan byl nalezen v roce 1905 a váží 3106 karátů, názvy má řada dalších kamenů o hmotnosti 100-800 karátů; 1 karát = 0,2 g). Anorganickými zdroji uhlíku jsou v zemské kůře soli kyseliny uhličité (vápenec CaCO3, magnezit MgCO3, dolomit CaCO3.MgCO3 a trona Na2CO3 .NaHCO3.2H2O), v atmosféře a v minerálních vodách je tento prvek obsažen ve formě oxidu uhličitého. Organického původu jsou uhlí, ropa a asfalt. Rozkladem organických sloučenin uhlíku bez přístupu vzduchu nebo jejich nedokonalým spalováním vznikají různé druhy uhlí (dřevěné, kostní, retortové, živočišné), koks a saze. Dříve byly považovány za amorfní formy uhlíku, nyní je známo, že mají grafitickou strukturu.

[Zobrazit video]
| Dřevěné uhlí lze připravit suchou destilací dřeva |
Grafit má vrstevnatou strukturu, která způsobuje výraznou anizotropii jeho fyzikálních vlastností. Jeho měkké (0,5-1 v Mohsově stupnici) černošedé šupinkovité krystaly jsou podél vrstev snadno štípatelné a mají menší hustotu (2,22 g.cm-3) než diamant (ρ = 3,51 g.cm-3).

[Zobrazit video]
| Ukázka grafitu |
Grafit je poměrně dobrým vodičem elektřiny i tepla. Existuje v hexagonální α-formě (uspořádání ABAB) a méně stabilní rhomboedrické β-formě (ABCABC). Přeměna α- na β-modifikaci je možná mechanickým mletím, opačný pochod zahřátím nad 1025 °C. Je známa i forma s náhodným uspořádáním vrstev.
Diamant (b. t. 4000 °C) je nejtvrdší přírodní látkou (10 v Mohsově stupnici) s vysokým indexem lomu. Nevede elektrický proud, ale má nejlepší známou tepelnou vodivost.

[Zobrazit video]
| Diamant |
Krystaluje v kubické soustavě (každý atom uhlíku je tetraedricky obklopen čtyřmi sousedy ve vzdálenosti 154,45 pm), nejčastěji jako průhledné (někdy příměsemi zbarvené) oktaedry.
Je metastabilní modifikací, přeměnu na grafit lze uskutečnit zahřátím (na 1800 až 2000 °C) bez přístupu vzduchu. Přestože jde o slabě exotermickou reakci, za laboratorní teploty prakticky neprobíhá
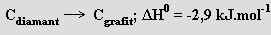
Technické diamanty (o hmotnosti do 0,1 karátu) se vyrábějí (od roku 1955) za vysokých teplot a tlaků s použitím malých množství přechodných kovů (chrom, mangan, železo, kobalt, nikl, platinové kovy; pravděpodobně rozpouštějí grafitický uhlík a umožňují jeho krystalizaci jako diamant) jako katalyzátorů.
Ostatní modifikace uhlíku jsou vzácné. Hexagonální lonsdaleit(1967, nalezen v meteoritickém kráteru v Arizoně, USA) lze připravit z monokrystalů α-grafitu za vysokého tlaku a teploty 1000 °C. Bílý chaoit (1968, objeven v kráteru Ries v Bavorsku) a uhlík(VI) (1972, byl připraven uměle z grafitického uhlíku při 2300 °C a nižším než atmosférickém tlaku) jsou také hexagonálními modifikacemi s dosud detailně neurčenou krystalovou strukturou. Základním strukturním motivem jsou v nich pravděpodobně řetězce -C≡C-C≡C-.
Objev uhlíkových klastrů známých nyní jako fullereny je spojen se jmény R. Smalleyho a H. Krota (1985), kteří pomocí hmotnostní spektroskopie prokázali v parách po laserovém odpaření grafitu existenci pozoruhodně stabilních útvarů C60 a C70.Vyslovili současně hypotézu, že se jedná o kulovité nebo kouli blízké útvary, jejichž povrch je tvořen pěti- a šestičlennými cykly. Experimentálně se ji podařilo potvrdit až po objevu postupu vedoucího k izolaci makromnožství těchto látek (W. Krätschmer, 1990). Jako jejich generátor byl použit elektrický oblouk mezi grafitovými elektrodami v nádobě naplněné heliem za sníženého tlaku, jejíž stěny byly chlazeny vodou. Extrakce produktu (vzhledem připomínajícího saze) benzenem vedla k vínově červenému roztoku obsahujícímu klastry C60 a C70, které bylo možno separovat chromatograficky. Dnes jsou obě tyto látky komerčně dostupné a byly publikovány postupy přípravy dalších fullerenů (C76, C84).
Reálná je i syntéza jednotek s několika sty atomů uhlíku, fullerenových trubic a soustředných fullerenových slupek. V C60 byly rentgenograficky zjištěny dvě různé vzdálenosti C-C, a konjugace systému π-vazeb na celém povrchu koule. Předpokládá se, že v organické syntéze mohou tyto principiálně nové skelety sehrát podobně významnou úlohu jako svého času benzenové jádro.
Nejčastější oxidační stavy uhlíku jsou +IV a - IV, méně se uplatňuje +II. Podle typu hybridizace (sp3, sp2 nebo sp) tvoří čtyři, tři nebo dvě σ-vazby a žádnou, jednu nebo dvě π-vazby. Atom uhlíku má vysoké hodnoty ionizačních energií a netvoří proto jednoduché kladně nabité ionty, dominujícím typem vazebné interakce je kovalence. Elektronegativita uhlíku (2,5) je poměrně nízká a není proto schopen tvořit vodíkové můstky.
Charakteristickou vlastností uhlíku je schopnost řetězení daná vysokou pevností jednoduché (C-C 154,2 pm, 356,0 kJ.mol-1) i násobných (C=C 132,6 pm, 611,7 kJ.mol-1; trojná C≡C 120,4 pm, 804,3 kJ.mol-1) vazeb mezi uhlíkovými atomy. Značně vysoké jsou také energie vazeb C-H (414,4 kJ.mol-1) a C-O (336,0 kJ.mol-1). Typická je schopnost atomů uhlíku tvořit delokalizované systémy π-vazeb (černošedé zbarvení, neprůsvitnost a kovový lesk grafitu jsou důsledkem přítomnosti delokalizovaného systému π-elektronů). Vazebné schopnosti uhlíku jsou příčinou rozmanitosti a stálosti jeho sloučenin.
V atmosféře kyslíku shoří diamant při teplotě vyšší než 800 °C bezplamenným žárem na oxid uhličitý, pro grafit je postačující teplota 690 °C. Při vysokých teplotách poskytuje grafit s vodíkem acetylen, s chlorem hexachlorethan a hexachlorbenzen, s dusíkem dikyan, se sírou sirouhlík a s kovy karbidy. Jeho razantní oxidací vzniká kyselina mellitová C6 (COOH)6. Chemické chování grafitu určuje jeho vrstevnatá struktura, která umožňuje vznik interkalátových sloučenin. Reakcí grafitu s roztavenými alkalickými kovy vznikají sloučeniny o složení MC8, jejich zahřátím na vyšší teplotu MC16. Nasycením grafitu parami bromu se tvoří C8Br (analogická sloučenina jodu není známa). V obou případech dochází ke zvýšení elektrické vodivosti až na úroveň vodivosti kovů. Účinkem fluoru při 450 °C se tvoří elektricky nevodivý fluorid grafitu o složení CxFy, v němž se poměr x:y může blížit jedné (s rostoucím obsahem fluoru klesá intenzita jeho zbarvení, rozkládá se na perfluorované uhlovodíky). Působením silných oxidačních činidel (KClO3, KMnO4) vzniká elektricky nevodivý oxid grafitu (žlutá až tmavohnědá kyselina grafitová) o složení CxOy, v němž se poměr x:y blíží limitní hodnotě 2:1. Sloučenina vždy obsahuje i malé množství vodíku a původní vrstevnatá struktura v ní zůstává zachována. Vzdálenosti mezi vrstvami se absorpcí vody mohou zvětšit z 0,6 až na 1,1 nm. Jsou známy i soli grafitu s hraničním složením C24X (X = HSO4−, NO3−). Interkaláty tvoří i některé chloridy kovů MClx (x = 2-6), oxidy (SO3 , N2O5; nikoliv SO2, NO a NO2) a sulfidy (V2S3, PdS, Sb2S5).
Grafit má rozsáhlé praktické použití a průmyslově se při nedostatku přírodních zdrojů vyrábí zahříváním koksu a křemene v elektrické peci (Achesonova metoda; 2500 °C, 24 hodin). Používá se na výrobu elektrod, žáruvzdorných materiálů, tužek, mazadel, pigmentů, ochranných nátěrů na železo a moderátorových tyčí pro jaderné reaktory. Kvalitní přírodní bezbarvé diamanty se brousí jako drahokamy, průmyslové diamanty (karbonádo) se používají k broušení a řezání tvrdých materiálů. Některé formy uhlíku s nepravidelnou strukturou a velkým povrchem (karborafín) se používají k adsorpci plynů.