
Křemičitany a různé formy oxidu křemičitého jsou spjaty s vývojem člověka od prehistorických dob (mezinárodní název křemíku silicium je odvozen z latinského silex = pazourek). Izolaci volného prvku dlouho bránila jeho velká afinita ke kyslíku (podařila se až v roce 1823 J. J. Berzeliovi, který zredukoval K2SiF6 draslíkem). Úspěchem posledních několika desetiletí je technologie výroby vysoce čistého křemíku pro elektroniku, která je současně ukázkou plodné spolupráce chemie s fyzikou pevných látek. Chemické vlastnosti sloučenin křemíku jsou velmi pestré a setkáváme se s nimi proto v celé řadě moderních technologií.
Křemík je po kyslíku nejrozšířenějším prvkem v zemské kůře (27,2 %, ve vesmíru až 7. prvek), obsahuje ho třetina všech známých nerostů. Směrem od středu k povrchu zeměkoule jeho obsah roste. Nachází se téměř výlučně ve formě kyslíkatých sloučenin - oxidu křemičitého (křemen, tridymit, cristobalit) a hydratované formy chalcedon, pazourek, achát, křemičitanů a hlinitokřemičitanů (přibližně 97 % zemské kůry do hloubky 16 km tvoří kyslíkaté sloučeniny křemíku).

[Zobrazit video]
| Ukázka barevných odrůd oxidu křemičitého |
Má tři stabilní izotopy, z nichž 29Si je vhodný pro použití v NMR-spektroskopii (4,67 %, I = ½).
Elementární křemík (b. t. 1420 °C, b. v. 3280 °C, ρ = 2,33 g.cm-3) je modrošedá, lesklá, dosti tvrdá (7 v Mohsově stupnici) a křehká krystalická látka, jejíž elektrický odpor v souladu s polovodivým charakterem prvku s teplotou klesá. Krystaluje v kubické soustavě (rSi-Si = 235 pm) se strukturou podobnou diamantu. Za vysokých tlaků lze připravit druhou, rovněž kubickou, modifikaci s deformovaným tetraedrickým uspořádáním atomů křemíku mající vyšší hustotu (2,55 g.cm-3) a meziatomové vzdálenosti 230 a 239 pm.
Nejčastější oxidační stav křemíku je +IV a -IV, velmi málo se uplatňuje +II. Nepolární kovalentní vazby Si-Si existují v elementárním křemíku a některých silanech a halogensilanech, všechny ostatní vazby jsou silně polární (vazba Si-O v oxidu křemičitém je z 50 % iontová). Pro malou elektronegativitu (1,8) není křemík schopen tvořit vodíkové můstky. Přes shodný počet elektronů ve valenčních sférách křemíku a uhlíku se jejich chemie výrazně liší. Křemík postrádá pro uhlík charakteristickou schopnost řetězení vzhledem k přibližně poloviční energii vazby Si-Si oproti vazbě C-C. Rovněž vazby Si-H jsou podstatně slabší než C-H. Silany jsou proto na rozdíl od alkanů nestálé a reaktivní. Vazby s kyslíkem a lehčími halogeny jsou naopak pevnější u křemíku než u uhlíku. Křemík je schopen tvořit více než čtyři σ-vazby, k tvorbě π-vazeb využívá d-orbitalů (vazby pπ-dπ hrají významnou úlohu ve struktuře křemene i kondenzovaných křemičitanů). Struktura některých analogických sloučenin uhlíku a křemíku (SiO2/CO2, SiS2/CS2) je proto zcela odlišná, chemie křemíku nezná obdobu karboxylových kyselin a v chemii uhlíku neexistují analoga křemičitanů a hlinitokřemičitanů.
Křemík není příliš reaktivní prvek. Za vysokých teplot se slučuje s kyslíkem na SiO2, s halogeny na SiX4, se sírou na sulfid SiS2, s dusíkem na nitrid Si3N4, s uhlíkem na karbid SiC a s většinou kovů na silicidy. S vodou reaguje až při teplotě červeného žáru
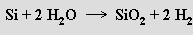
Je rezistentní vůči všem kyselinám s výjimkou kyseliny fluorovodíkové. V roztocích alkalických hydroxidů se rozpouští za vývoje vodíku
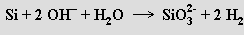
Křemík se vyrábí redukcí oxidu křemičitého karbidem vápenatým nebo uhlíkem
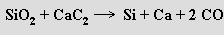
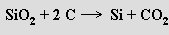
Vysoká energetická náročnost obou reakcí vyžaduje použití elektrických pecí. V praxi se redukce uhlíkem uskutečňuje v přítomnosti železného šrotu a získá se tak slitina křemíku se železem (ferrosilicium), která se v hutnictví používá jako technický křemík. Za vhodných podmínek může vznikat i karbid křemičitý SiC.

[Zobrazit video]
| Aluminotermická příprava křemíku z oxidu křemičitého |
Vysoce čistý křemík se získává redukcí hexafluorokřemičitanu draselného Na2SiF6 (odpadní produkt v průmyslu fosforečných hnojiv) sodíkem. Následným čištěním zonální tavbou lze získat kov s obsahem nečistot 10-9-10-12 %, který se používá k výrobě tranzistorů.