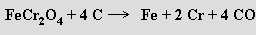
Chrom je svým rozšířením (122 ppm) srovnatelný s vanadem a chlorem, molybden a wolfram jsou o dva řády vzácnější (1,2 ppm). Počet přírodních izotopů je v rozmezí čtyři (chrom) až sedm (molybden). Nejvýznamnějším minerálem chromu je podvojný oxid chromit FeCr2O4, molybden se nachází jako molybdenit MoS2 a wolfram v scheelitu CaWO4 a wolframitu (Fe,Mn)WO4.
Chrom je stříbrobílý vysoce vyleštitelný kov, molybden a wolfram jsou šedé kovy s vysokými body tání i varu (wolfram je s 3380 °C nejvýše tající kov vůbec). Všechny tři prvky krystalují v prostorově centrované kubické mřížce.
Prvky 6. skupiny mohou vystupovat v oxidačních stavech +VI až -II, nejstabilnější oxidační stupně jsou +III u chromu a +VI u molybdenu a wolframu. CrVI existuje téměř výlučně v oxosloučeninách, které jsou silnými oxidačními činidly. Určitou podobnost prvků 16. a 6. skupiny lze nalézt pouze u sloučenin obsahujících chrom resp. síru v oxidačním stavu +VI (podobná rozpustnost a izomorfie řady síranů a chromanů, SO3/CrO3, SO2Cl2/CrO2 Cl2). V komplexech jsou nejvyšší oxidační stavy chromu stabilizovány výlučně nejelektronegativnějšími partnery (O, F), nižší π-donorovými ligandy (hexakarbonylchrom [Cr0(CO)6], bis(benzen)chrom [Cr0(C6H6)2], pentakarbonylchromidový aniont [Cr-II(CO)5]2−).
Chrom, molybden i wolfram jsou za laboratorní teploty na vzduchu stálé (pokrývají se neviditelnou, ale souvislou vrstvičkou oxidu), po zahřátí reagují s řadou nekovů. Snadno se chemicky i elektrochemicky pasivují a stávají se pak odolnými i proti účinku zředěných kyselin. Z hydridů je znám pouze CrH, karbid Cr3C2 je reaktivnější než karbidy prvků, které mu v první přechodné řadě předcházejí.
Halogenidy chromové s výjimkou fluoridu nejsou známy. Sloučeniny molybdenové a wolframové nemají výrazné oxidační vlastnosti (sloučeniny WVI jsou stabilnější než MoVI) a mimo hexafluoridů jsou známy i další hexahalogenidy MX6 (s výjimkou MoBr6, MoI6 a WI6). Sloučeniny chromičné a chromičité jsou stálé jen v bezvodém stavu, ve vodném roztoku rychle disproporcionují na sloučeniny chromité a chromové. Sloučeniny chromnaté jsou ve vodném prostředí silnými redukčními činidly (rychlost a kvantitativnost jejich reakce s dikyslíkem se využí vá při odstraňování stop kyslíku z inertních plynů) a přecházejí na sloučeniny chromité.
Redukcí chromitu v elektrické peci koksem se připravuje slitina chromu se železem (obsahuje i uhlík) zvaná ferrochrom
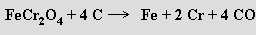
Čistý chrom lze připravit elektrolýzou roztoků chromitých solí nebo aluminotermicky
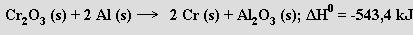
Při výrobě molybdenu se nejprve pražením molybdenitu připraví oxid molybdenový
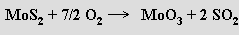
a ten se na kov převede redukcí vodíkem
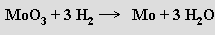
Wolfram se získává z wolframitu, který se tavením s uhličitanem nebo hydroxidem sodným převede na rozpustný wolframan sodný
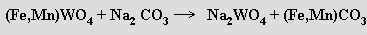
Vyloužením produktu vodou a okyselením získaného roztoku se získá hydratovaný oxid wolframový WO3.xH2O (kyselina wolframová)
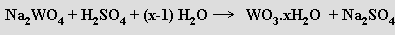
který se pak termicky dehydratuje ä nakonec redukuje vodíkem (850 °C). Oba kovy tak vznikají ve formě prášků, které se na kompaktní kov požadovaného tvaru a rozměrů zpracují metodami práškové metalurgie (slinováním při vysoké teplotě a tlaku v atmosféře vodíku).
Ferrochrom se přidává do ocelí ke zlepšení mechanických vlastností i odolnosti proti korozi. Slitiny železa s niklem (≈ 8 %) a chromem (≈ 18 %) jsou nerezavějící oceli užívané v chemickém a potravinářském průmyslu. Chrom se také často používá k povrchové úpravě jiných kovů (z dekorativních nebo ochranných důvodů). Značné množství chromitu se spotřebuje na výrobu chrommagnezitových cihel používaných k vyzdívání vysokých pecí při výrobě železa. Molybden a wolfram se používají jako legovací přísady do ocelí, z wolframu se (od roku 1908) vyrábějí žárovková vlákna.