V molekule mají atomy dané předem definované vzájemné pozice. Základní molekulární geometrii dokážeme zjistit z Lewisových vzorců, které nám poskytují sterické číslo. Sterické číslo představuje počet vazeb a nevazebných elektronových párů kolem centrálního atomu. Charakterizovat geometrické uspořádání molekuly můžeme pomocí délky vazeb a vazebných úhlů. Délka vazby představuje přímou vzdálenost mezi středy jader dvou atomů spojených vazbou. Vazebné úhly jsou úhly mezi kteroukoli dvojicí vazeb, které zahrnují společný atom.
Tabulka č. 7: Porovnání ideálního a reálného tvaru molekul, a s toho vyplývajících uhlů
| Výchozí tvar | Vazebné uhly | Reálný tvar | Vazebné uhly |
|---|---|---|---|
Lineární | 180° | Lineární | 180° |
Rovnostranný trojúhelník | 120° | Rovnostranný trojúhelník | 120° |
Lomený | ≤ 120° | ||
Pravidelný tetraedr | 109,5° | Pravidelný tetraedr | 109,5° |
Trigonální pyramida | ≤ 109,5° | ||
Lomený | ≤ 109,5° | ||
|
Trigonální bipyramida |
Ekvatoriální uhel 120° Axiální uhel 90° |
Trigonální bipyramida |
Ekvatoriální uhel 120° Axiální uhel 90° |
|
Disfenoid |
Ek - Ek 120° Ax - Ax 180° Ax - Ek 90° |
||
|
T- tvar |
Ax - Ax 180° Ax - Ek 90° |
||
|
Lineární |
180° |
||
|
Oktaedr |
90° |
Oktaedr |
90° |
|
Tetragonální pyramida |
≤ 90° |
||
|
Čtverec |
90° |
||
|
Pentagonální bipyramida |
Ekvatoriální uhel 72° Axiální uhel 90° |
Pentagonální bipyramida |
Ek - Ek 72° Ax - Ax 180° Ax - Ek 90° |
Molekulární geometrie je obecný tvar molekuly a popisuje vzájemné pozice atomových jader. Na zjištění prostorové struktury molekuly slouží tři teorie chemické vazby a molekulární geometrie. VSEPR (Valence Shell Electron-Pair Repulsion), je soubor empirických pravidel, který uvažuje elektrostatické působení atomů a volných elektronových párů v molekule. VBT (Valence Bond Theory) která je založena na kvantových efektech a hybridizaci atomových orbitalů. MO-LCAO (Molecular Orbitals – Linear Combination of Atomic Orbitals) vyplývá z představy o tvorbě molekulárních orbitalů lineární kombinací atomových orbitalů při vzniku chemické vazby.
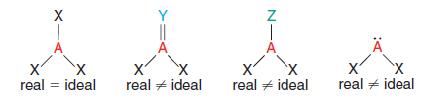
Teorie VSEPR klade vyšší důraz na vliv repulze valenčních elektronových párů, jejich prostorové uspořádání představuje minimum odpudivé energie. Elektronový pár se chce co nejvíce přiblížit k jádru, ale zároveň chce být co nejdále od ostatních elektronových párů. Využívá se pro prvky hlavních skupin a přechodné kovy s elektronovou konfigurací d0 a d10.
Repulze elektronových párů klesá v pořadí od nejsilnějšího po nejslabší: dva nevazebné elektronové páry, vazby s σ-interakcí a jednoduchá vazba, jednoduchá vazba a nevazebný pár, dvě jednoduché vazby. Mnohem větší vliv na geometrii mají volné elektronové páry a násobné vazby, než vazby jednoduché. Základní tvary zahrnují i nevazebné elektronové páry a z nich pak vznikají tvary odvozené, u kterých uvažujeme pouze polohy atomů.
Tabulka č. 8: Tvary VSEPR podle sterického čísla a elektronových párů
|
Počet volných elektronových párů |
||||
|
Sterické číslo |
0 |
1 |
2 |
3 |
|
2 |
AB2(Lineární) |
|||
|
3 |
AB3(Trojúhelník) |
AB2E1(Lomený) |
||
|
4 |
AB4(Tetraedr) |
AB3E1(Trigonální pyramida) |
AB2E2 (Lomený) |
|
|
5 |
AB5(Trigonální bipyramida) |
AB4E1(Disfenoid) |
AB3E2(T-tvar) |
AB2E3(Lineární) |
|
6 |
AB6(Oktaedr) |
AB5E1(Tetragonální pyramida) |
AB4E(Čtverec) |
|
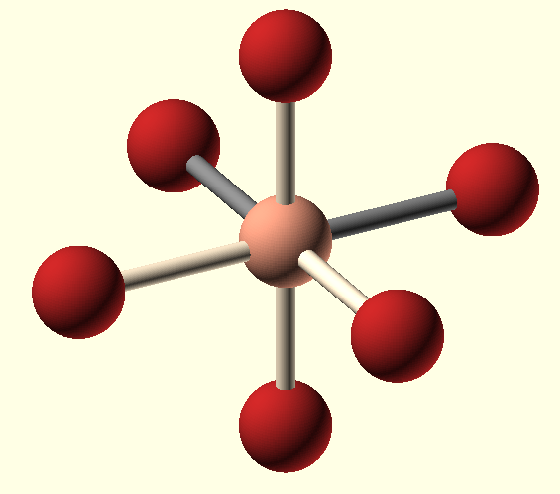
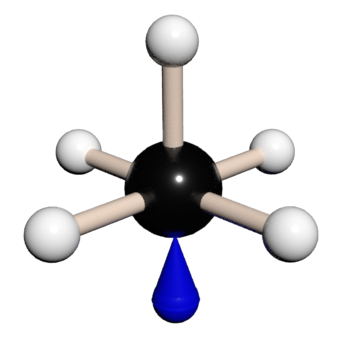
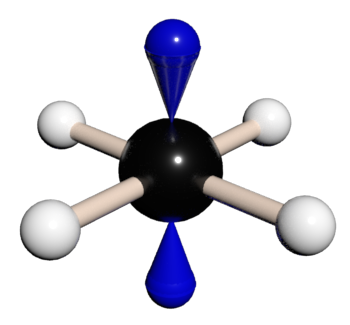
Tabulka č. 9: Tvary a symetrie molekul (4)
| Sterické Číslo | Typ | Tvar molekuly | Hybridizace | Symetrie | Příklady |
|---|---|---|---|---|---|
| 2 | AB2 | Lineární | sp | D∞h | NO2+ |
| ABE | Lineární | C∞v | PO+ | ||
| 3 | AB3 | Trigonální (trojúhelník) | sp2 | D3h | BCl3 ; CO32− ; NO3-; MnO3+; |
| AB2E | Lomený | C2v | SO2; NO2− ; [ClO2]+ | ||
| AA2E | Lomený | C2v | O3 | ||
| ABCE | Lomený | Cs | NOCl | ||
| ABE2 | Lineární | C∞v | - | ||
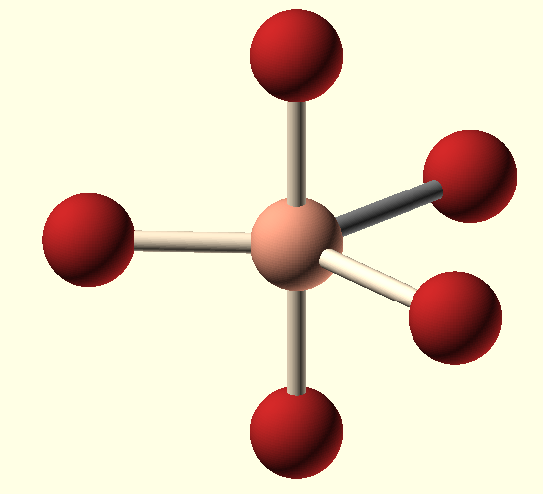
| 4 | AB4 | Tetraedr | sp3 | Td | NH4+; XeO4; ClO4-; BF4−; SO42−; PO43− |
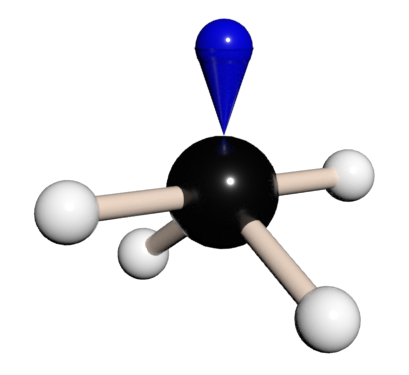
| AB3E | Trigonální pyramida | C3v | [H3O]+ [HSO4]−; NCl3; NF3; XeO3; SO32−; ClO3−; NH3; PH3 | ||
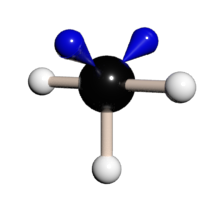
| AB2E2 | Lomený | sp3 | C2v |
Cl2O; I3+; ClO2− H2O; H2S; H2Se; H2Te |
|
|
ABE3 |
Lineární |
„sp3“ |
C∞v |
HCl; XeF+ |
|
|
5 |
AB5 |
Trigonální bipyramida |
sp3d |
D3h |
PF5; PCl5; [Fe(CO)5]; [SnCl5]−; SbCl5; |
|
AB5 |
Tetragonální pyramida |
C4v |
[InCl5]2−; [TlCl5]2−; Sb(C6H5)5 |
||
|
AB4C |
Trigonální bipyramida |
C2v |
SOF4 |
||
|
AB4E |
Hexaedr |
C2v |
SF4 |
||
|
AB3CE |
Nepravidelný tetraedr |
Cs |
F3ClO |
||
|
AB3E2 |
T-tvar |
C2v |
ClF3; BrF3; [XeF3]+ |
||
|
AB2E3 |
Lineární |
D∞h |
XeF2−; [I3]−; BrF2− |
||
|
6 |
AB6 |
Oktaedr |
sp3d2 |
Oh |
SF6; PF6 − |
|
AB5E |
Tetragonální pyramida |
C4v |
XeOF4 |
||
|
AB4E2 |
Čtverec |
D4h |
XeF4; ICl4−; BrF4− |
||
|
7 |
AB7 |
Pentagonální pyramida |
sp3d3 |
D5h |
IF7 ; UF73− ; ZrF73− |
|
AB6E |
Pravidelný oktaedr |
Oh |
TeCl62−; SbBr63− |
||
|
AB6E |
Pentagonální pyramida s vertikální E |
C5v |
XeF6 |
Proces dehybridizace můžeme pozorovat ve strukturách typu AB4, AB3E a AB2E2, kde s rostoucím počtem volných elektronových párů označovaných E, klesá hodnota vazebného úhlu. Daný pokles vazebného úhlu u některých sloučenin koreluje se snížením podílu orbitalu s v lineárních kombinacích původních atomových orbitalů. Původní hybridizace blízka sp3 hybridizaci se u těchto sloučenin následně blíží spíše p3 či p2 (8).
Tabulka č. 10: Hybridizace a vazebné uhly (8)
|
Počet volných elektronových párů E |
|||||||
|---|---|---|---|---|---|---|---|
|
0 |
1 |
2 |
2 |
||||
|
AB4 |
AB3E |
AB2E2 |
AB2E2 |
||||
|
CH4 |
109,5° |
NH3 |
106,8° |
H2O |
104,5° |
OF2 |
103° |
|
SiH4 |
109,5° |
PH3 |
93,5° |
H2S |
92,5° |
SF2 |
98° |
|
GeH4 |
109,5° |
AsH3 |
92,0° |
H2Se |
91,0° |
SeF2 |
94° |
|
SnH4 |
109,5° |
SbH3 |
91,5° |
H2Te |
89,5° |
- |
|
Metoda VSEPR není použitelná pro typ AB8 a následující typy se sterickým číslem osm až deset, protože charakter vazby se mění z kovalentního na iontový. K nepoužitelnosti této metody přispívá i růst velikosti středového atomu, který výrazně ovlivňuje koordinaci. (8)
Hybridizace je koncept, který popisuje sjednocení energeticky různých atomových orbitalů, a vytvoření nových hybridizovaných orbitalů. Je to matematický model, který popisuje atomové orbitaly na základě pozorování molekulových orbitalů. Rozdíl mezi těmito dvěma typy orbitalů je v tom, že molekulové orbitaly vznikají mezi dvěma atomy, a hybridní orbitaly na stejném atomu. Hybridizace přímo souvisí s tvarem molekul, a vazebnými vlastnostmi, protože vysvětluje umístění hybridních orbitalů v prostoru a vznik kovalentních vazeb. (9)
Hybridizace typu sp představuje proces vzniku dvou sp hybridizovaných orbitalů spojením jednoho s orbitalu s jedním p orbitalem. Vzniklé dva sp hybridizované orbitaly označujeme jako degenerované, což znamená, že mají stejnou energii. Když hybridizované orbitaly vytvoří vazbu, vzniknou molekulové orbitaly se stejným rozložením elektronové hustoty. Výsledný tvar je lineární s vazebným uhlem 180°. Dva p orbitaly, které nebyli využité v procesu hybridizace, se mohou podílet na vzniku dvojné nebo trojné vazby. (9)
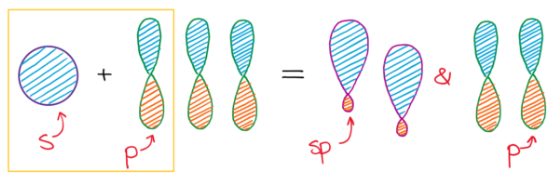
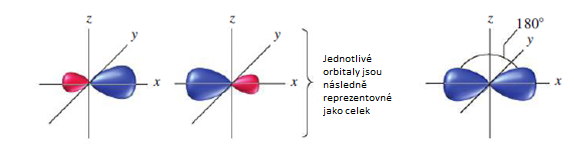
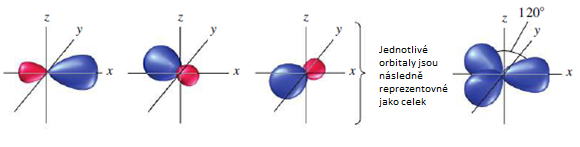
Hybridizace sp2 představuje proces vzniku tří sp2 hybridizovaných orbitalů spojením jednoho s orbitalu se dvěma p orbitaly. Tři vzniklé sp2 hybridizované orbitaly jsou degenerované, mají tedy stejnou energii a rozložení elektronové hustoty. Prostorové uspořádaní vazeb je trigonálně planární a vazebný uhel je 120°.
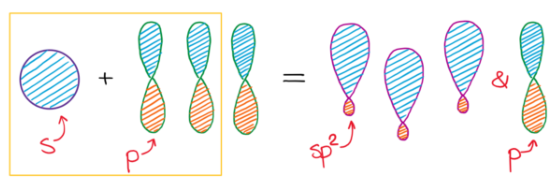
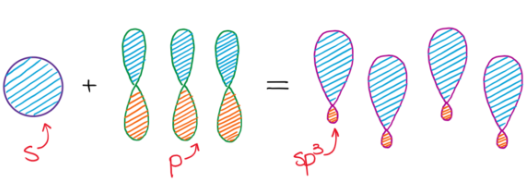
Hybridizace sp3 představuje proces vzniku čtyř sp3 hybridizovaných orbitalů spojením jednoho s orbitalu se třemi p orbitaly. Čtyři vzniklé sp3 hybridizované orbitaly označujeme jako degenerované, co znamená, že mají stejnou energii. Degenerace všech čtyř sp3 orbitalů nám poskytuje představu, o prostorovém uspořádaní vazeb, vycházejících z atomu v dané hybridizaci. Když hybridizované orbitaly vytvoří vazbu, vniklé molekulové orbitaly mají taky stejné rozložení elektronové hustoty. Jelikož jsou všechny čtyři orbitaly stejné energeticky i z hlediska elektronové hustoty, rozloží se v prostoru co nejsymetričtěji vytvářející se tetraedrické uspořádání. Vazebný uhel v tetraedru představuje 109,5°, s molekulovými orbitaly směřujícími do rohů tetraedru. (9)
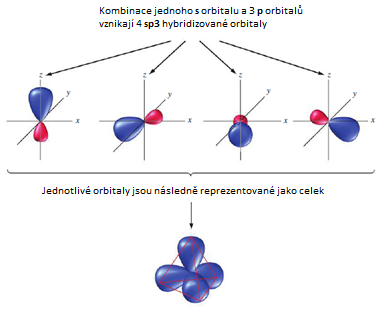
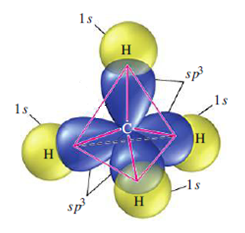
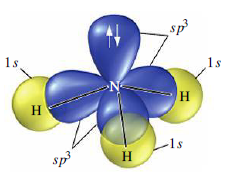
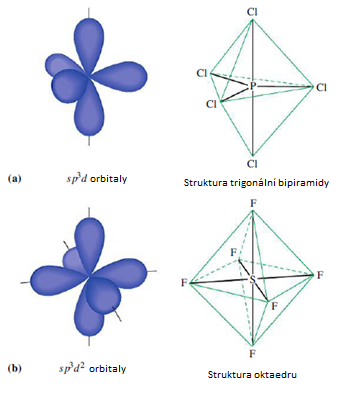
Hybridizace sp3d představuje proces vzniku pěti sp3d hybridizovaných orbitalů spojením jednoho s orbitalu se třemi p orbitaly a jedním d orbitalem. Pět vzniklých sp3d hybridizovaných orbitalů označujeme jako degenerované, což znamená, že mají stejnou energii. Hybridizaci sp3d můžou mít atomy ze třetí periody a vyšší. Tvoří prostorovou strukturu trigonální bipyramidy s úhlem 90° v axiální rovině a 120° v ekvatoriální rovině.
Hybridizace sp3d2 představuje proces vzniku šestisp3d2 hybridizovaných orbitalů spojením jednoho s orbitalu se třemi p orbitaly a dvěma d orbitaly. Šest vzniklých sp3d2 hybridizovaných orbitalů označujeme jako degenerované, což znamená, že mají stejnou energii. Hybridizaci sp3d2 tvoří oktaedrickou strukturu s oběma úhly 90° v ekvatoriální i axiální rovině.