Pevné látky, kapaliny či plyny, rozlišujeme podle jejich fyzikálních vlastností, které závisí na jejich struktuře. Pevná látka se vyznačuje strukturální tuhostí a odolností vůči změnám tvaru nebo objemu. Pokud je kinetická energie tepelného pohybu stavebních částic nízká a teplota je pod bodem tuhnutí dané látky, jedná se o pevné skupenství. Pevné látky si zachovávají tvar a objem, nepůsobí-li na ně vnější síly a nemění se teplota. Atomy, ionty a molekuly se v pevném skupenství stabilně propojí, vznikají tedy chemické vazby. Atomy v pevné látce jsou navzájem pevně spojeny buď pravidelně v mřížce, nebo nepravidelně. Stále dochází k určitým teplotním vibracím kolem uzlových bodů, ale stavební prvky jsou periodicky a homogenně uspořádány v prostorové mřížce. Pevné látky rozlišujeme na krystalické (3.3.2) a amorfní (3.3.1), v závislosti na uspořádání elementárních částic - atomů, iontů či molekul. Kromě několika výjimek minerály vytvářejí krystaly. Můžeme uvést opál (SiO2 . xH2O) nebo limonit (Fe2O3 . xH2O), které nazýváme minerály amorfní nebo beztvaré. Minerály mají charakteristický krystalický stav, který je dán jejich vnitřní strukturou. (11)
Amorfní látky mají náhodné uspřádání stavebních částic, a proto se jejich strukturní stav podobá kapalnému. Naproti tomu existuje u amorfních látek omezené periodické uspořádání s krátkým dosahem, a to na vzdálenost přibližně 10-8m. Vyznačují se izotropií fyzikálních a chemických vlastností, a nejednoznačnou teplotou tání. Fyzikální vlastnosti jsou ve všech směrech stejné, proto je označujeme jako izotropní látky. Mezi amorfní látky řadíme sklo, pryskyřice, vosky, plasty a polymery. Polymery představují makromolekulární látky organického původu s propletenou strukturou sítě, jsou to například kaučuk, bavlna, celulóza, bílkoviny a termoplasty. (10)
Amorfní pevná látka zvaná sklo je výsledkem zahřívání oxidu křemičitého nad bodem tání přibližně 1600 ° C a následným rychlým ochlazením. Sklo na rozdíl od krystalické povahy křemene, má náhodné uspřádání. Sklo je homogenní a připomíná nekrystalický viskózní roztok. Vlastnosti skla mohou být velmi ovlivněny pomocí přísad. Běžně používané sklo vzniká přidáním Na2CO3 do taveniny oxidu křemičitého před ochlazením. Přidáním B2O3 vzniká borosilikátové sklo, které odolává velkým teplotním změnám. Změna roztažnosti je užitečná nejen pro borosilikátové laboratorní sklo, ale i aluminosilikátové kuchyňské sklo. Nejběžnější obchodní značkou borosilikátového skla je Pyrex. Přidáním K2O se produkuje obzvláště tvrdé sklo, které může být vybroušeno do přesných tvarů využívané v optice pro brýle. Kromě Na2CO3, B2O3, K2O představují další příměsi látky jako CaO a MgO.
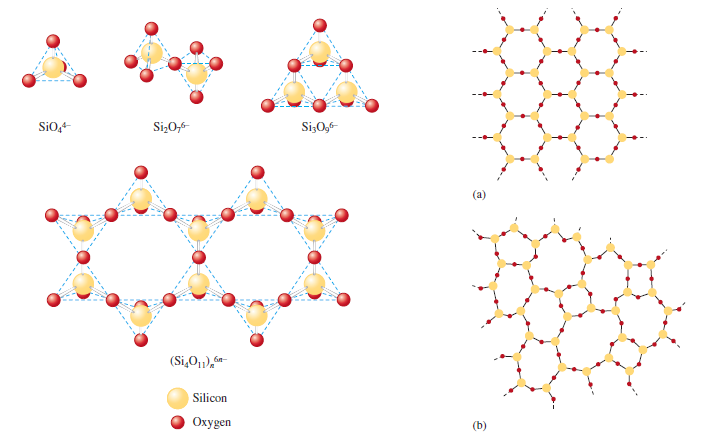
Krystalické látky mají strukturní uspořádání s nejnižší vnitřní energii, a proto představují energeticky nejstabilnější stav. Dále se vyznačují pravidelným uspořádáním strukturních částic, které jsou obvykle spojovány do stavebních jednotek. Krystalické látky mohou vytvářet pravidelná tělesa – krystaly, které mají charakteristické tvary v závislosti na symetrii vnitřního uspořádání. Krystal má vymezený svůj vnější tvar plochami, které se sbíhají v hranách a rozích. Vyznačuje se stálým chemickým složením a charakteristickým ostrým bodem tání. Podle specifického uspořádání a velikosti částic ve struktuře materiálů rozlišujeme monokrystaly a polykrystaly.
Monokrystaly jsou charakteristické periodicky se opakujícím uspořádáním stavebních částic v celém objemu krystalu. Jedná se o uspořádání s delším dosahem, které vytváří pravidelné geometrické tvary monokrystalů. Označujeme je jako anizotropní látky, u kterých fyzikální vlastnosti závisí na směru vzhledem ke stavbě krystalu. Příkladem látek, které se hojně vyskytují ve formě monokrystalů jsou kamenná sůl – NaCl, křemen – SiO2, diamant, slída, Si a Ge. Kvůli těmto vlastnostem se křemík a germanium používají na výrobu polovodičů.
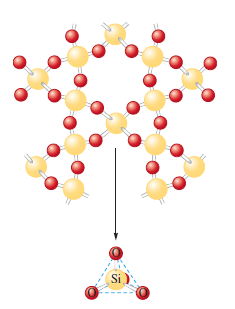
Polykrystalické látky jsou složené z většího počtu drobných krystalků – zrn. Samotná zrna mají náhodnou polohu, avšak stavební částice uvnitř zrn jsou uspořádané pravidelně. Izotropní vlastnosti polykrystalů znamenají, že mají ve všech směrech uvnitř stejné vlastnosti. Většina pevných látek se vyskytuje ve formě polykrystalů, například všechny kovy jsou většinou polykrystaly.
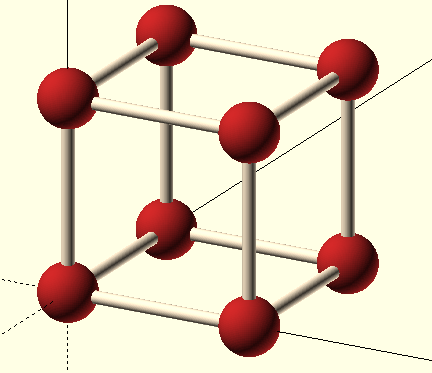
Tuhé krystalické těleso může být charakterizováno pravidelným rozložením stavebních částic, které kmitají kolem specifických poloh, tvořících prostorovou mřížku. Ideální krystalovou mřížku dostaneme posouváním základní buňky podél jejích prodloužených hran. Krystalová mřížka je abstraktní pojem a představuje periodicky se opakující strukturní body nazývané uzly. Uzlové body mají stejnou hodnotu fyzikálních a geometrických vlastností. To znamená, že jsou stejné a jsou stejně orientované v okolí. Spojením uzlových bodů rovnoběžnými přímkami dostáváme elementární buňky.
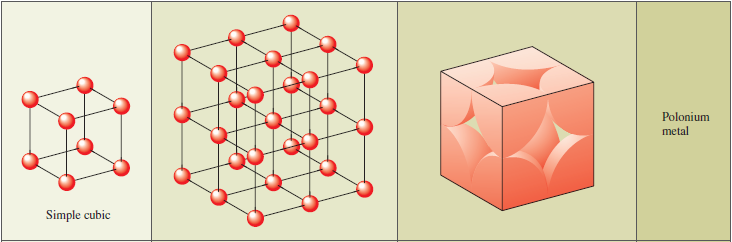
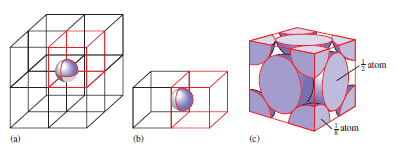
Elementární buňka mřížky je libovolný rovnoběžnostěn, který vzniká rozdělením prostoru vzhledem k poloze částic v trojrozměrné soustavě rovnoběžek. Nejjednodušší pravoúhlý rovnoběžnostěn je krychle. Pokud je známa délka hrany krychle a rozmístění částic v ní, lze určit stavbu celého krystalu. Kubická základní buňka může být prostá, plošně centrovaná nebo prostorově centrovaná. Krystalová struktura je tedy složena z krystalové mřížky a stavebních částic uspořádaných kolem identických uzlů mřížky.
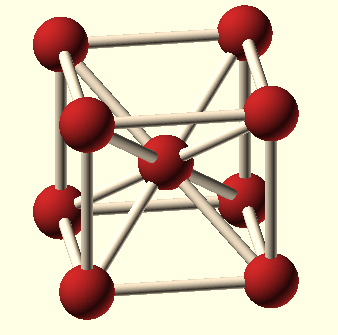
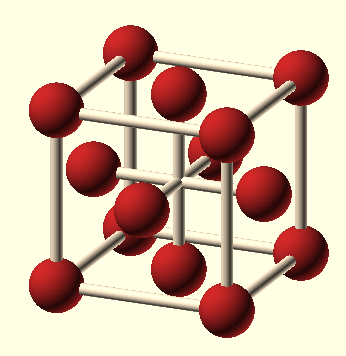
Tabulka č. 11: Typy elementárních krychlových buněk
|
Typ elementární krychlové buňky |
Rozložení atomů |
Počet atomů na 1 základní buňku |
Objem vyplněný atomy |
Příklady |
|---|---|---|---|---|
|
prostá |
každý vrchol buňky je společný osmi buňkám |
1 |
52% |
Po alfa |
|
prostorově centrovaná |
každý vrchol buňky je společný osmi buňkám, atom ve středu náleží pouze k dané buňce |
2 |
68% |
Li, Na, U, Cr, Fe |
|
plošně centrovaná |
každý vrchol buňky je společný osmi buňkám, každá stěna dvěma buňkám |
4 |
74% |
Al, Cu, Ni, Au |
Zaplnění prostoru jednotlivých typů základních buněk nemůže být 100% vzhled k sférickému tvaru atomů. Objem, který zaplňují atomy v dané základní buňce, vydělíme objemem samotné základní buňky, a dostaneme procentuální zaplnění prostoru. Nejprve ale vynásobíme počet atomů nacházejících se v základní buňce objemem koule . Důležitý je pro zjištění objemu základní buňky, směr, jakým se atomy dotýkají navzájem. Následně dokážeme vyjádřit délku hrany d dané základní buňky, pomocí poloměru r atomů. Objem krychlové základní buňky je d3. (10)
Demonstrujeme na příkladu výpočtu procentuálního zaplnění prostoru plošně centrované základní buňky, která obsahuje čtyři atomy. Z toho vyplývá, že objem koule vynásobíme čtyřmi a dostaneme objem, který zaplňují atomy v plošně centrované buňce.
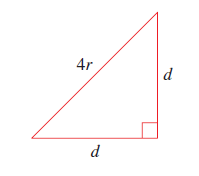
$$\text{objem atomů} = 4\times \dfrac {4\pi r^3} {3} = 16\pi r^3 $$Atomy v plošně centrované buňce se dotýkají podél úhlopříčky stěny základní buňky, proto délku úhlopříčky vyjádříme jako 4r. Když víme, že úhlopříčka d, hrana a základní buňky svírají 45° úhel, dokážeme vyjádřit délku hrany základní buňky. Úhel cos (45°) = /2, vynásobíme délkou úhlopříčky.
$$ \text{hrana}\quad d = 4 \times \cos 45^{\circ} = 4r\times \dfrac {\sqrt 2} {2} = 2\sqrt 2 r $$Vyplnění prostotu plošně centrované základní buňky vypočteme vydělením objemů atomů objemem buňky.
$$ \text{Vyplnění prostoru} = \dfrac {\text{objem atomů}} {\text{objem základní buňky}} = \dfrac {\frac {16} 3 \pi r^3} {(2\sqrt 2)^3r^3} = 0.74 \times 100 = 74 \% $$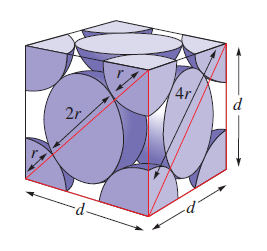
Určení elementárních buněk se řídí čtyřmi pravidly, na základě kterých bylo odvozeno 14 Bravaisových translačních hranolů neboli mřížek. Souměrnost elementární buňky se musí shodovat se soustavou, do které patří krystal. Musí mít maximální počet stejných hran a úhlů mezi nimi. Musí mít maximální počet pravých úhlů. Objem buňky musí být minimální při dodržení prvních tří pravidel. (3)
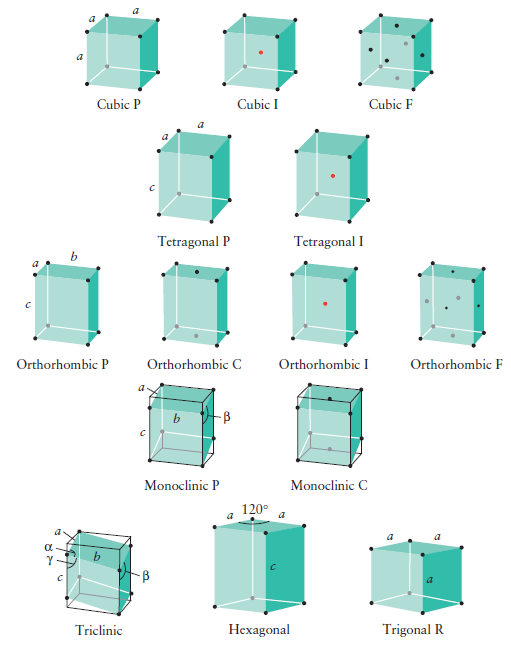
Na základě vzájemné volby se rozlišuje 7 krystalografických tříd (soustav):
Tabulka č. 12: Typy krystalografických soustav (3)
|
Typ soustavy |
Úhly |
Příklady |
|
|---|---|---|---|
|
triklinická (trojklonná) |
a ≠ b ≠ c |
α ≠ β ≠ γ ≠ 60°, 90°, 120° |
chalkantit (modrá skalice), kaolinit, plagioklas |
|
monoklinická (jednoklonná) |
a ≠ b ≠ c |
α = γ, β > 90° |
β -S8 |
|
ortorombická (kosočtverečná) |
a ≠ b ≠ c |
α = β = γ = 90° |
Ga, γ-As, α-S8 |
|
tetragonální (čtverečná) |
a = b ≠ c |
α = β = γ = 90° |
β-Sn, Ag, β-U |
|
trigonální (klencová romboedrická) |
a = b ≠ c |
α = β ≠ 90°, |
β-Po, Bi, Sb, červený fosfor |
|
hexagonální (šesterečná) |
a = b ≠ c |
α = β = 90°, γ =120° |
Zn, Be, Ti, Mg, Tc |
|
kubická (krychlová) |
a = b = c |
a = b = g = 90° |
As, Sb, Bi, α-Po |
Mezi částicemi pevné látky vždy působí vazebné síly. Tyto síly k sobě vážou atomy, ionty nebo molekuly chemickou vazbou podobně jako síly mezi atomy v osamocených molekulách. Na základě vznikajících vazeb rozlišujeme tyto typy krystalů: iontové, kovalentní, kovové a molekulové.
Tabulka č. 13: Klasifikace krystalů
| Typy krystalů | Typy vazeb | Vlastnosti | Příklady |
|---|---|---|---|
|
Iontové |
Iontová vazba |
Relativně vysoký bod tání, tvrdé, |
MgO, NaCl, CuSO4.5H2O |
|
Kovalentní |
Kovalentní vazba |
Vysoký bod tání, tvrdé, silné i slabé tepelné a elektrické vodivosti, nízká hustota, pevné |
Diamant – C, grafit, křemen - SiO2 |
|
|
Vodíková vazba, Interakce |
Nízký bod tání, slabá tepelná a elektrická vodivost, nízká hustota, měkké |
CO2, H2O, BeCl2, |
|
Kovové |
Kovová vazba |
Variabilní tvrdost a bod tání v závislosti na síle kovové vazby, vysoká tepelná a elektrická vodivost |
Mg, Cd, K, Co |
Iontové krystaly mají strukturní částice vázané iontovou vazbou. Jedná se o vazbu přenosem elektronů, která se vytváří mezi elektronegativním prvkem a elektropozitivním prvkem. Elektropozitivní jsou například prvky 1. skupiny nazývané alkalické kovy, které uvolní elektron a stanou se z nich kationty. Elektronegativní prvky přijmou uvolněný elektron a stanou se aniontem, příkladem jsou prvky 17. skupiny označovány jako halogeny. V krystalové mřížce jsou kationty a anionty poutány elektrostatickou silou. Iontové krystaly se vyznačují značnou tvrdostí a poměrně vysokými teplotami tání. V závislosti na teplotě se mohou chovat jako elektrické izolanty při běžných teplotách, nebo jako iontové vodiče při vyšších teplotách. Iontové krystaly jsou propustné pro viditelné světlo. Příkladem těchto krystalů mohu být krystaly alkalických halogenidů nebo krystaly oxidů alkalických zemin.
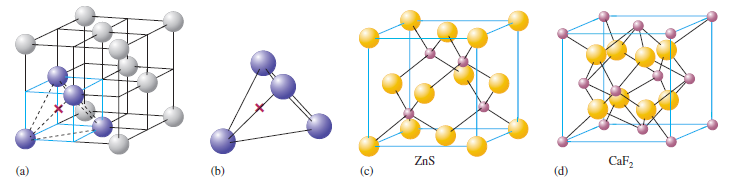
Strukturu chloridu sodného jako většinu binárních iontových pevných látek, je možné vysvětlit nejtěsnějším uspřádáním atomů. Všeobecně větší ionty, obvykle anionty, tvoří hexagonální nebo kubické nejtěsnější uspořádání, zatímco menší kationty zapadají do mezer mezi anionty. Dané uspořádání maximalizuje elektrostatickou přitažlivost mezi opačně nabitými ionty, a snaží se minimalizovat odpuzování mezi ionty se stejnými náboji. V případě NaCl se sodné kationty nachází v oktaedrických mezerách plošně centrované kubické buňky.
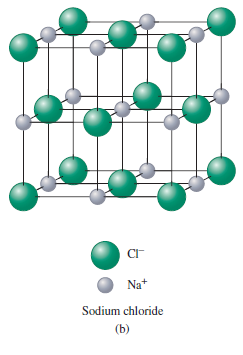
Iontová pevná látka musí být celkově neutrální. Stechiometrie sloučeniny, tedy poměr počtu aniontů ke kationtům, je určována iontovými náboji. Rozložení daných iontů v pevné látce je přibližně určeno pomocí relativních velikostí iontů.
Kovalentní krystaly mají atomy vázané sdílením elektronů se sousedními atomy, přičemž dané elektrony patří oběma atomům. Charakter vazby je směrový a nasycený, protože se zohledňuje úhel navázání a mocenství navázaných atomů. Kovalentní krystaly se vyznačují tvrdostí, vysokými teplotami tání a nerozpustností v běžných rozpouštědlech. Jako příklad kovalentních krystalů můžeme uvést krystal křemíku nebo diamant.
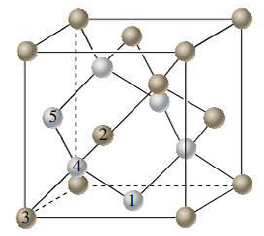
Kovalentní krystalické pevné látky obsahující silné směrové kovalentní vazby, mohou vytvářet struktury podobné sítím. Pro ilustraci sítě pevné látky budeme v této sekci budeme diskutovat dva velmi důležité prvky, uhlík a křemík a některé jejich sloučeniny. Uhlík se vyskytuje v různých formách alotropických modifikacích, jako jsou diamant, grafit a fullereny. Fullereny jsou molekulární pevné látky, ale diamant a grafit jsou sítě propojených atomů. V diamantu má atom uhlíku tetraedrické uspořádání a je obklopen dalšími čtyřmi atomy uhlíku. Z hybridizace sp3 a stabilizace kovalentní vazbou vyplývá, že diamant, je elektrický izolátor, tedy nevede elektrický proud. Diamant je tvrdý, v podstatě bezbarvý. (10)
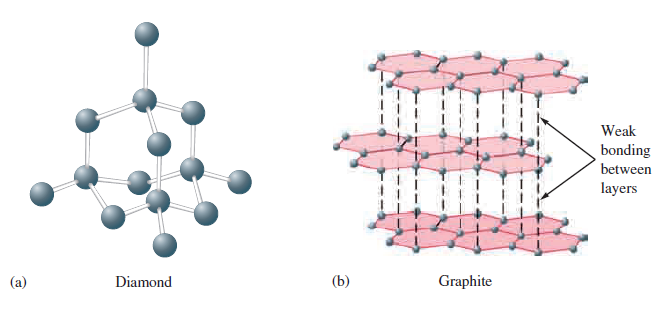
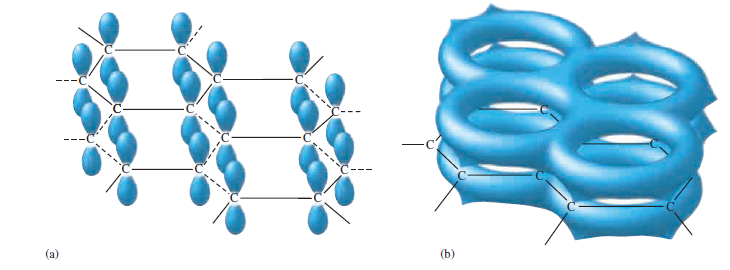
Struktura grafitu je založena na vrstvách atomů uhlíku uspořádaných do šestiúhelníku. Každý atom uhlíku v grafitu je obklopen třemi dalšími atomy uhlíku v trigonálním rovinném uspořádání s vazebnými úhly 120°. Tři orbitaly sp2 na každém uhlíku se používají k vytvoření σ vazeb na tři další atomy uhlíku. Zbylé nehybridizované 2p orbitaly na každém atomu uhlíku se podílejí na stabilizaci π a na delokalizaci elektronů. Grafit se často používá jako mazivo v zámcích. Charakteristickou kluzkost grafitu lze vysvětlit tím, že grafit má velmi silné spojení uvnitř vrstev mezi atomy uhlíku, ale slabé spojení mezi vrstvami prostřednictvím van der Waalsových sil.
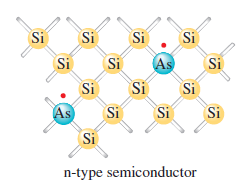
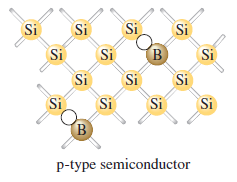
Elementární křemík má stejnou strukturu jako diamant, ale je to polokov a také polovodič. V kovech vodivost klesá s rostoucí teplotou, zatímco v polovodičích roste. Nízká vodivost křemíku může být zvýšena dopováním křemíkových krystalů některými dalšími prvky. Když je, malá část atomů křemíku nahrazena atomy arsenu vytvoří se polovodič typu n. Vodivost je zvýšena dotováním atomy s větším počtem valenčních elektronů než mají atomy v základním krystalu. Můžeme také zvýšit vodivost křemíku dotováním krystalu borem. Protože bór má o jeden valenční elektron méně, než je nutné k vytvoření vazeb, v okolí atomu bóru se vytvoří elektronová mezera. Když nějaký elektron vyplní tuto díru, zanechá jinde novou mezeru, a opakováním mezera postupuje skrz krystal proti pohybu elektronů. Když jsou polovodiče dotovány atomy, které mají méně valenčních elektronů než atomy základního krystalu, nazýváme je polovodiče typu p. Nejdůležitější aplikace polovodičů zahrnují spojení p-typu a n-typu k vytvoření p-n propojení, které převádí střídavý proud na stejnosměrný proud.
Molekulové krystaly obsahují molekuly, které jsou spojeny slabými vazbami elektrické povahy – van der Waalsovy síly, Londonovy disperzní síly, dipól-dipólové interakce a vodíkové vazby. Molekulové krystaly jsou měkké krystaly s nízkou teplotou tání. Za velmi nízkých teplot jsou molekulové krystaly typické u inertních plynů, za nízkých teplot je tvoří například argon, chlor, kyslík, vodík, oxid uhličitý a za normálních teplot jod nebo organické látky jako například sacharóza.
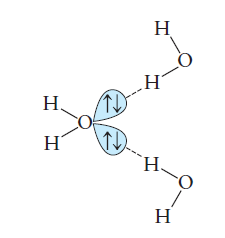
Molekulové krystalické látky jsou pevné látky, ve kterých molekuly zaujímají mřížkové polohy. Běžným příkladem je led, kde jsou polohy obsazeny molekulami vody. Když molekuly mají dipólové momenty, jejich intermolekulární síly jsou obvykle větší, zejména pokud se může vytvořit vodíková vazba. Každá molekula vody má dvě polární O – H vazby a dva volné páry elektronů na atomu kyslíku, což vede ke spojení čtyř atomů vodíku s každým kyslíkem. Pomocí dvou relativně krátkých kovalentních vazeb kyslíku a vodíku, a dvou delších interakcí dipól-dipól kyslíku a vodíku, které lze vidět ve struktuře ledu.
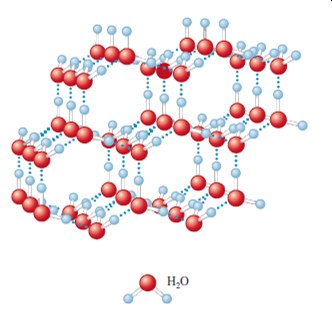
Další příklady jsou pevný oxid uhličitý nazývaný suchý led, molekulární forma síry, které obsahují S8 molekuly, bílý fosfor, který obsahuje molekuly P4 a fullereny, které obsahují molekuly jako například C60 nebo C70. Pro tyto látky jsou charakteristické silné kovalentní vazby v molekulách, ale relativně slabé mezimolekulové síly. Rozdíly mezi kovalentními a slabými vazbami závisí na interatomických a intermolekulárních vzdálenostech atomů v pevných látkách. Molekuly jako je CO2, I2, P4 a S8, mají nulové dipólové momenty a intermolekulární síly jsou slabé Londonové disperzní síly. Očekávání je, že tyto látky jsou plyny při určité teplotě, jako je tomu v případě oxidu uhličitého. Když se velikost molekul zvyšuje, Londonovské disperzní síly jsou silnější.
Kovové krystaly představují krystaly kovových prvků, které mají valenční elektrony slabě vázáné k atomovému jádru a proto se snadno uvolňují. Kovová vazba představuje silnou všesměrovou vazbu (10). Volné elektrony se nevážou k dalšímu atomu, ale pohybují se mezi kationy kovových atomů. Valenční elektrony jsou delokalizovány v celém krystalu, což poskytuje silnou soudržnou sílu, která drží atomy kovu pohromadě.
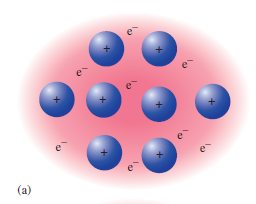
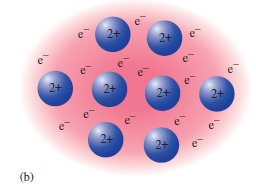
Tyhle elektrony tvoří elektronový plyn, který stíní elektrostatické silové působení kationtů v mřížce. Na druhou stranu drží atomy spolu jako celek zprostředkováním elektrostatické přitažlivé síly, čehož lze využít právě u kovových materiálů. Protože i když je obtížné oddělit atomy kovů, je relativně snadné je posunout, pokud atomy zůstanou ve vzájemném kontaktu.
Kovové krystaly nejčastěji znázorňujeme pomocí sférických atomů sdružených a navzájem propojených ve všech směrech. Dané modely představují s různou efektivitou uspřádání atomů s ohledem na využití dostupného prostoru. Většina kovů má strukturní uspořádání, které nazýváme nejtěsnější uspořádání, a to hexagonální nebo kubické. Hořčík a zinek mají hexagonální uspřádání. Hliník, stříbro, měď, kobalt a nikl nalézáme v nejtěsnějším kubickém uspořádání. Kovy, jako například železo, se nachází v krychlovém uspořádání charakterizovaném tělesně centrovanou základní buňkou. Vápník může krystalizovat v obou uspořádáních. Prostá kubická buňka má atom v každém rohu krychle. Prostá kubická buňka je známa pouze pro strukturu jedeného prvku, polonia. Kovalentní síly jsou v poloniu tak silné, že překonají tendenci k vytvoření nejtěsnějšího uspořádání.
Kovové krystaly se vyznačují velmi dobru tepelnou a elektrickou vodivostí, dobrou kujností a tažností. V silnějších vrstvách jsou neprůhledné a mají charakteristický povrchový lesk. Příkladem kovových krystalů jsou všechny kovy jako měď, železo, hliník a platina. Kovové vazby bývají nejslabší pro prvky, které mají téměř prázdné nebo téměř plné valenční vrstvy. Cesium taje při 28,4 ° C a rtuť je kapalina při pokojové teplotě. Nejsilnější vazby jsou u prvků s přibližně napůl zaplněnými valenčními vrstvami, wolfram taje při 3680 ° C (10).
Samotná povaha kovové vazby a struktura kovů umožňuje vytvoření materiálů nazývaných slitiny. Slitina je směs kovů, u které se projevují odlišné kovové vlastnosti jako u jejích základních prvků. Substituční slitiny jsou vytvořeny nahrazením jednoho atomu kovu jiným s podobným rozměrem v mřížce. Intersticiální slitiny vznikají vložením menších atomů do otvorů v kovové mřížce. Další možností je kombinace obou typů nazývané slitinové ocele. Ačkoli základní složení většiny slitin se může lišit v širokém rozmezí, určité kovy se kombinují pouze v pevných poměrech a vytvářejí intermetalické sloučeniny s jedinečnými vlastnostmi.
Koordinace je určena poměrem poloměrů centrálního atomu nebo iontu a poloměrů obklopujících atomy nebo ionty. Počet obklopujících sousedních atomů představuje koordinační číslo. Čím větší koordinační číslo tím větší je centrální dutina. Spojením středů obklopujících atomů nebo iontů vnikají různé pravidelné mnohostěny, které nazýváme koordinační polyedry.
Tabulka č. 14: Typy koordinačních polyedrů (6)
|
Koordinační polyedr |
Koordinační číslo |
Příklady |
|---|---|---|
|
Tetraedr |
4 |
diamant, Si, Ge |
|
Oktaedr |
6 |
Po |
|
Krychle |
8 |
Alfa-železo |
|
Nejtěsnější uspořádání |
12 |
Zn, Mg, Cu, Au |
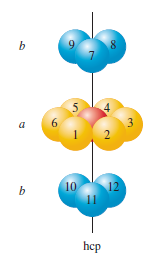
Atomy jsou řazeny do vrstev, ve kterých je každá koule obklopena dalšími šesti. V druhé vrstvě atomy zaujímají místo nad mezerami nebo důlky tvořenými třemi atomy první vrstvy. Ve třetí vrstvě existují dva způsoby obsazení mezer druhé vrstvy, uspořádání aba nebo abc. V případě uspořádání aba každý atom ve třetí vrstvě leží přímo nad atomem v první vrstvě. Výsledná struktura je šestiboká základní buňka, a nazývá se hexagonální nejtěsnější uspořádání (hcp – hexagonal closes packing).

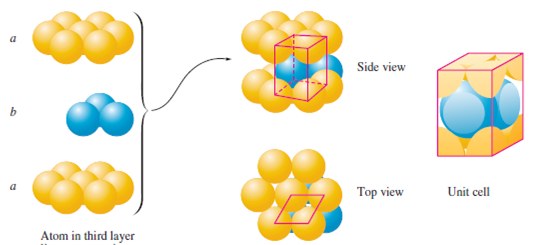
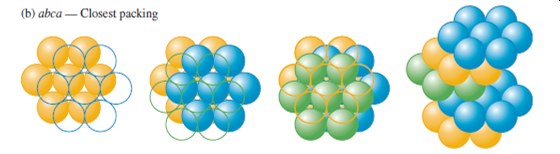
U uspořádání abc se obsazují pozice, tak že žádný atom ve třetí vrstvě neleží přímo nad atomy v první vrstvě. Výsledná struktura se nazývá kubické nejtěsnější uspořádání (ccp – cubic closest packing). Základní buňka s uspořádáním abc je kubická plošně centrovaná. Charakteristické pro obě struktury je, že každý atom má 12 ekvivalentních nejbližších sousedů. Z hlediska praktického využití pevných látek je důležité znát celkový počet atomů v konkrétní základní buňce.

Ve struktuře nejtěsnějšího uspořádání rozlišujeme tři typy mezer. Trigonální mezery jsou tvořeny třemi atomy ve stejné vrstvě. Tetraedrické díry se nachází mezi atomem sedícím v jamce tří atomů v sousední vrstvě. Oktaedrické díry se tvoří mezi dvěma protistojně umístěnými sadami tří atomů v sousedních vrstvách. Těchto šest stejně vzdálených atomů propojením vytváří osmistěn. (10)
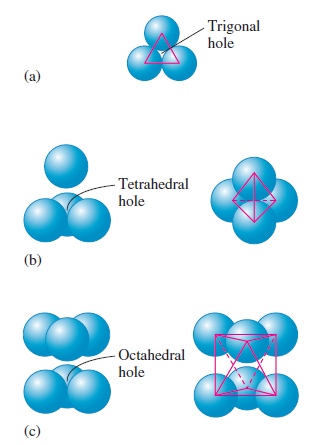
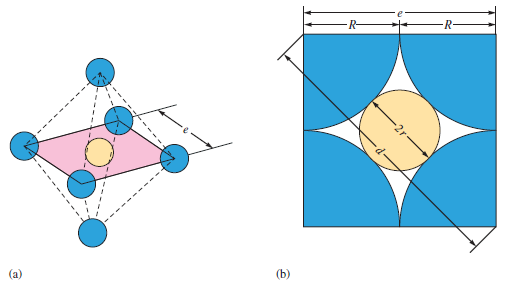
Velikost daných mezer stoupá v řade trigonální, tetraedrická, oktaedrická. Trigonální mezery jsou tak malé, že se neobsazují ionty u binárních sloučenin. (2.3.3.1) Obsazení tetraedrických a oktaedrických mezer záleží hlavně na relativní velikosti aniontu a kationtu. V plošně centrované buňce nejtěsnějšího uspořádání je osm tetraedrických děr. Jedna plošně centrována buňka obsahuje celkově čtyři atomy. Počet tetraedrických děr se rovná dvojnásobku počtu atomů v základní buňce nejtěsnějšího uspořádání.
Nejjednodušší oktaedrická díra v struktuře nejtěsnějšího uspořádání je ve středu krychle a je obklopena šesti atomy, což je nutné pro vytvoření oktaedru. Zbývající oktaedrické mezery jsou sdíleny s dalšími základními buňkami a je obtížnější je vizualizovat. Nacházejí se na středech hran. Počet oktaedrických děr je stejný jako počet atomů v základní buňce nejtěsnějšího uspořádání, tedy čtyři. (10)
Jednotlivé látky se liší typem vazby, polaritou vazeb a tvarem. Tyto vlastnosti ovlivňuji celkovou polaritu molekul tedy dipólový moment. V závislosti na tvaru molekuly vyhodnocujeme výslednou polaritu, která může ovlivnit rozpustnost, reaktivitu, biologickou aktivitu a fyzikální vlastnosti. Tyto souvislosti využívají různá chemická, technická a farmaceutická odvětví na modifikaci vlastností známých materiálů nebo vývoj nových materiálů. (12)
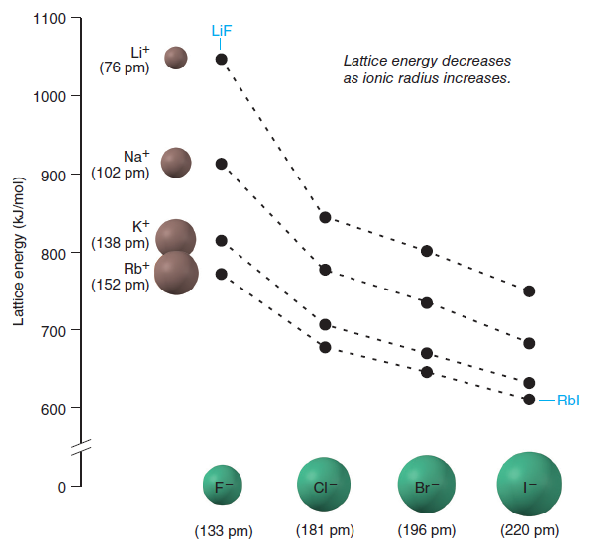
Pomocí výzkumné metody RTG difrakce bylo dokázáno, že ve vnitřní stavbě krystalů mají významnou roli atomové a iontové poloměry. S rostoucím protonovým číslem, směrem vertikálně v PSP, se iontové poloměry zvětšují. V periodách iontové poloměry klesají zleva doprava pod vlivem rostoucího náboje jádra. Blízkou hodnotu iontových poloměrů vykazují prvky uložené v PSP diagonálně. Zmenšení iontového poloměru nastává při zvýšení oxidačního čísla prvku. Anionty mají větší poloměry než kationty.
Polarizace vzniká při vyšší koncentraci kladných nábojů kationtu v blízkosti aniontu, nebo při vyšší koncentraci záporných nábojů aniontu v blízkosti kationtu. Malé vzdálenosti mezi ionty výrazně přispívají k polarizaci. Vzniklé komplexní anionty se skládají z malých kationtů s vyšším oxidačním číslem, které jsou obklopeny většími anionty s nižšími oxidačními čísly například dusičnany.