Cytologické vyšetření
Kvantitativní cytologie
Počet buněk je nutno určit neprodleně po dodání materiálu. Buňky mají v likvoru nízkou životnost a mohou lyzovat již během první hodiny od odběru. Kvantitativní stanovení počtu elementů v mozkomíšním moku se provádí ve Fuchs-Rosenthalově komůrce (Obr. 10). Fuchs Rosenthalova komůrka je tvořena speciálním sklem velikosti podložního sklíčka, kde jsou na dvou oddělených ploškách mikroskopické vrypy, které tvoří mřížku složenou z velkých a malých čtverců. Objem komůrky nad plochou vymezenou vrypy je 3 ul. Nejprve pipetujeme 20 ul nativního neobarveného likvoru do jedné z komůrek. Kapilární síly zajistí, že je mozkomíšní mok automaticky natažen do komůrky. V nativním neobarveném likvoru počítáme erytrocyty a jaderné elementy. Jejich rozlišování zde neprovádíme, nemusí být snadné, zvláště pokud jsou červené krvinky minimálně probarveny nebo již nemají svůj charakteristický vzhled (Obr. 11). Do druhé části komůrky pipetujeme nativní obarvený likvor. Jako barvící roztok používáme kyselou metylvioleť. Na dno hodinového sklíčka se pipetuje 5 ul kyselé metylvioleti, přidá se 50 ul likvoru, pečlivě se promíchá a opatrně pipetuje do komůrky. Barvící roztok, kromě toho, že dobře znázorní jádra buněk, působí lýzu erytrocytů. (Obr. 12). Likvor je tekutina chudá na buňky, za normálních okolností je zde do 3 buněk/ul, to znamená, že v celé komůrce najdeme nejvíce 9 buněk. V tomto případě meandrovitě prohlédneme a spočítáme celý obsah komůrky (Obr. 13). Buňky počítáme při 200 násobném zvětšení. Pokud je likvor buněčný, jako bývá např. při zánětlivých onemocněních, při krvácení nebo při nádorové infiltraci, počítáme buňky pouze v části komůrky a výsledek vynásobíme příslušným faktorem (Obr. 14). V nativním preparátu se stanoví počet všech buněk, po obarvení počet jaderných buněk. Z rozdílu se vypočte počet erytrocytů. Za normální nález se považuje 0–3 leukocyty/ul. Diferenciace leukocytů na mononukleáry a polynukleáry je ve Fuchs-Rosenthalově komůrce málo spolehlivá a nedoporučuje se provádět.

Obr. 10 Fuchs-Rosenthalova komůrka
Obr. 11 Nativní neobarvený preparát Fuchs-Rosenthalova komůrka (zvětšení 400x)
Obr. 12 Nativní obarvený preparát kyselou metylvioletí Fuchs Rosenthalova komůrka (zvětšení 400x)
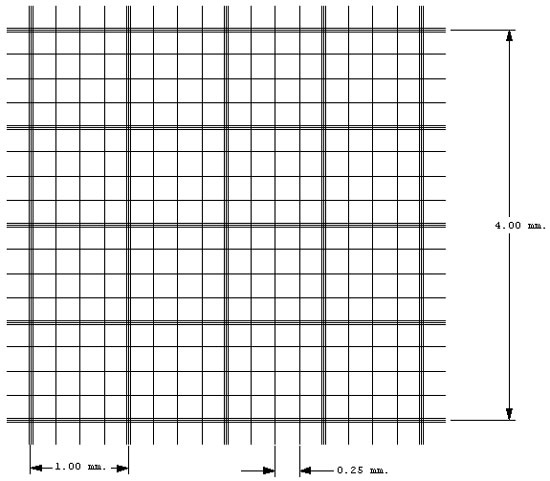
Obr. 13 Mikroskopická mřížka ve Fuchs Rosenthalově komůrce
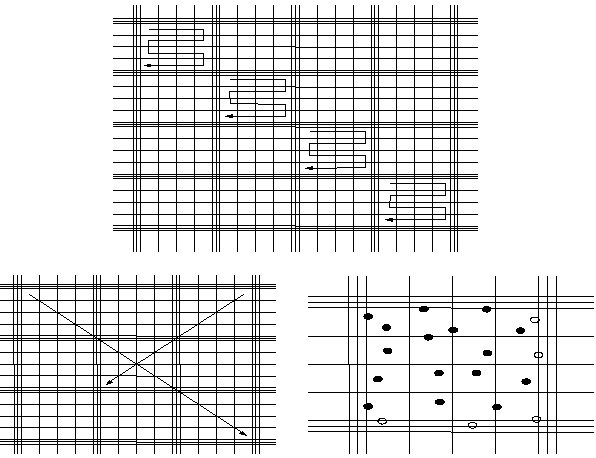
Obr. 14 Počítání elementů v buněčném likvoru
Kvalitativní cytologie
Vzhledem k relativně malému počtu buněčných elementů v likvoru je nutné pro cytomorfologické vyšetření likvor zahustit – tzn. získat buňky z většího objemu likvoru. K tomu slouží příprava mikroskopického preparátu pomocí šetrné cytocentrifugace. Likvor napipetovaný do speciálního nástavce je odstředivou silou tlačen proti podložnímu sklíčku. Kapalná část likvoru se vsakuje do přiloženého filtračního papíru a přítomné buněčné elementy zůstávají v kruhovém terčíku na skle. Cílem je získat preparát s optimální výtěžností buněk. Všechny populace buněk obsažené v mozkomíšním moku musí být v preparátu přítomny, aniž by se měnily jejich poměry a morfologie. Zkoncentrování mozkomíšního moku je obzvlášť významné pro zamezení přehlédnutí nádorových buněk. Trvalý cytologický preparát slouží k přesnější diferenciaci elementů a ke stanovení cytologického závěru. Po skončení centrifugace se držák s nádobkou a mikroskopickým podložním sklem vyjme z centrifugy, nádobka s filtračním papírem se odstraní a cytologický preparát v podobě kruhového terčíku se nechá zaschnout a následuje barvení. Základní barvící metodou v likvorologii je barvení podle Pappenheima, mohou se použít i modifikace tohoto barvení, např. barvící set Diff Quick, jehož výhodou je rychlost, barvení preparátu je hotové asi za 15 vteřin. Podložní sklíčko se 5x ponoří na jednu sekundu do fixačního roztoku s metanolem. Při přechodu do další lázně se sklíčko osuší buničitou vatou. Následuje opět 5x ponoření do barvícího roztoku, který obsahuje eosin ve fosfátovém pufru a jako poslední se 4x ponoří do barvy, která obsahuje thiaminovou modř ve fosfátovém pufru. Po obarvení v posledním barvicím roztoku se sklíčko s preparátem důkladně opláchne deionizovanou vodou. Po tomto barvení jsou eosinofilní složky v různých odstínech růžové a červené a bazofilní složky v různých odstínech světlemodré a tmavomodré. Podle vzoru si vyznačíme na sklíčku oblast záchytu buněk a preparát je připraven k rychlému mikroskopickému zhodnocení.
Typy buněk v mozkomíšním moku
Lymfocyt(klidový)
Buňka o velikosti 8–10 μm, má úzký plazmatický lem a kompaktní jádro, které vyplňuje téměř celou buňku (Obr. 15). Tyto buňky najdeme v normálním mozkomíšním moku. Lymfoidní buňky se po setkání s antigenem transformují a jejich vzhled se mění. Aktivovaný lymfocyt (reaktivní) je lymfoidní buňka 11–18 μm s výraznou bazofilní cytoplazmou a s velkým jádrem (Obr. 16). Vývojová řada T-lymfocytů končí u lymfoidních buněk, v plazmocyty se vyvíjejí pouze B-lymfocyty. T-lymfocyty jsou odpovědné za cytolýzu a aktivaci makrofágů. Plazmocyty jsou největší lymfoidní buňky o velikosti až 21 μm s bazofilní plazmou. Kulaté nebo oválné jádro s patrnými jadérky bývá uloženo excentricky. Typické je perinukleární projasnění plazmy (Obr. 17). Plazmocyty jsou konečným stadiem B-lymfocytů po imunologické stimulaci a produkují imunoglobuliny. Vyskytují se patologicky v mozkomíšním moku, nejčastěji u pacientů se záněty virového původu.
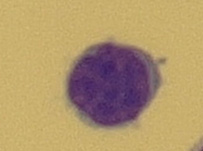
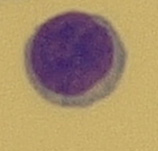 Obr. 15 Lymfocyt (zvětšení 1000x)
Obr. 15 Lymfocyt (zvětšení 1000x)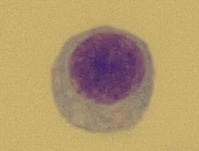
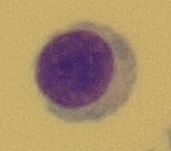 Obr. 16 Aktivovaný lymfocyt (zvětšení 1000x)
Obr. 16 Aktivovaný lymfocyt (zvětšení 1000x)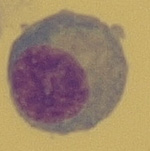
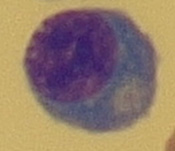 Obr. 17 Plazmocyt (zvětšení 1000x)
Obr. 17 Plazmocyt (zvětšení 1000x)Monocyty
Buňky velké 15–30 μm. Jádro mívá nepravidelný tvar, nejčastěji podkovy nebo fazole. Plazma se barví světleji než u lymfocytů (Obr. 18). Jsou to buňky morfologicky velmi proměnlivé. Aktivované monocyty se odlišují od monocytů větší velikostí a vakualizovanou plazmou. Jsou schopny fagocytózy jiných buněk nebo nebuněčných částic. Aktivované monocyty s pohlceným materiálem se nazývají makrofágy. Podle fagocytovaného materiálu lze rozlišit různé typy, např. erytrofágy, hemosiderofágy, lipofágy apod. Monocyty jsou součástí normálního buněčného obrazu, aktivované monocyty nebo makrofágy však svědčí pro patologický děj.
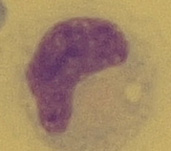
Obr. 18 Monocyt (zvětšení 1000x)Neutrofilní polymorfonukleáry
Buňky o průměrné velikosti 12–15 μm. Charakteristická morfologie s děleným jádrem a granuly v plazmě odpovídá krevním neutrofilům (Obr. 19). Za normálních okolností nejsou přítomny v mozkomíšním moku, k jejich zmnožení dochází při akutních zánětech, zejména bakteriálních. Výjimkou jsou novorozenci, pro nezralost hematolikvorové bariéry je u nich počet buněk zvýšený (do 15 buněk/ul) jsou přítomny i granulocyty. Granulocyty mají také schopnost fagocytózy, pohlcují např. bakterie. Nejsou však schopny fagocytovat jiné leukocyty nebo erytrocyty. Eosinofilní granulocyty jsou o něco větší než neutrofily. Jádro bývá nejčastěji rozděleno na dvě části a v plazmě je množství načervenalých granulí. V mozkomíšním moku jsou spíše vzácným nálezem – jejich výskyt může svědčit pro chronicitu procesu, dále je můžeme vidět u parazitárních onemocnění.
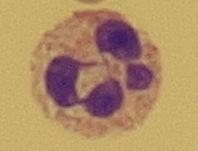
Obr. 19 Neutrofilní polymorfonukleár (zvětšení 1000x)Nádorové buňky
V mozkomíšním moku mnohem častěji pochází z extrakraniálních nádorů než intrakraniálních. Cytologické vyšetření mozkomíšního moku a pátrání po nádorových buňkách je významné zejména u pacientů s metastatickými tumory, u leukémií, lymfomů, primárních mozkových nádorů a u meningeálního dráždění neznámého původu. Mezi všeobecně uznávaná kritéria malignity buněk patří vysoký nukleoplazmový posun ve prospěch jádra, velká jadérka, časté dělení buněk, značná velikost buněk, tendence k buněčným shlukům (Obr. 20).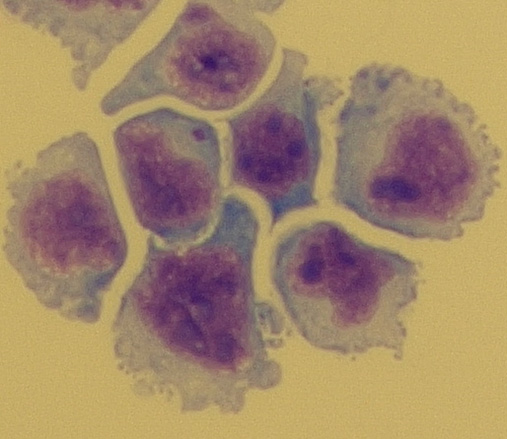
Obr. 20 Nádorové buňky (zvětšení 1000x)
Typy cytologických likvorových nálezů:
Podle početně převažující řady dělíme pleocytózu nebo patologickou oligocytózu na granulocytární, lymfocytární, monocytární nebo tumorózní.
Granulocytární pleocytóza
S převahou neutrofilů se vyskytuje u hnisavých zánětů, výskyt eosinofilů je častý u onemocnění parazitárních, mykotických nebo u chronických patologických procesů (Obr. 21)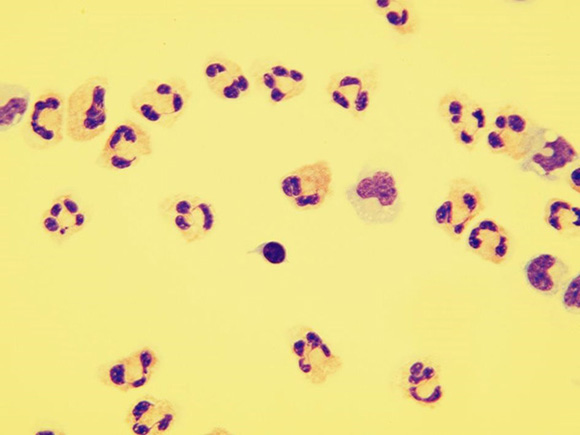
Obr. 21 Granulocytární pleocytóza (zvětšení 400x)Granulocytární oligocytóza
Častá v počáteční fázi nehnisavých zánětů nebo mozkové ischémie.Lymfocytární pleocytóza
Vyskytuje se u nehnisavých zánětlivých onemocnění (infekce virové, dále infekce způsobené borreliemi, leptospirami nebo bacily tuberkulózy) (Obr. 22)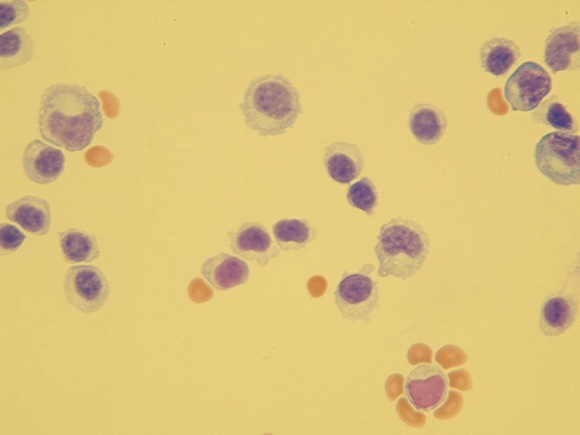
Obr. 22 Lymfocytární pleocytóza (zvětšení 400x)Lymfocytární oligocytóza
Často se nachází v počáteční fázi roztroušené sklerózy.Monocytární pleocytóza
Nebo oligocytóza s nálezem aktivovaných monocytů je nespecifickým nálezem charakteristickým pro neinfekční onemocnění – kompresivní syndrom, autoimunitní onemocnění. Nález je také charakteristický pro konečnou fázi zánětu.Tumorózní pleocytóza
Nebo oligocytóza svědčí pro maligní onemocnění.
Normální cytologický nález v likvoru znamená, že počet buněk nepřekračuje normu, tzn. 3–5/ul, jsou přítomny lymfocyty, monocyty, aktivované formy do 10 %.