4.2.6 Izomerie koordinačních sloučenin
Izomerie je jev v koordinační chemii velmi rozšířený. Izomery jsou sloučeniny, které mají navzájem stejné stechiometrické složení a shodnou relativní molekulovou hmotnost, ale liší se některými fyzikálně chemickými vlastnostmi (tvar molekuly, specifická optická otáčivost, dipólový moment a podobně).
Izomerii dělíme na strukturní a prostorovou.
4.2.6.1 Strukturní izomerie
a) vazebná izomerie:
Tentýž ligand se k centrálnímu atomu váže různými donorovými atomy. Sloučeniny odlišíme názvem ligandů.
Příklad:
 |
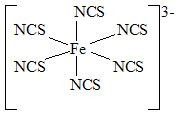 |
| hexathiokyanatoželezitanový anion | hexaisothiokyanatoželezitanový anion |
b) polohová izomerie ligandů:
Ligandy jsou navzájem svými polohovými izomery. Sloučeniny odlišíme názvem ligandů.
Příklad:
 |
pojmenování ligandu: 1,2-propandiamin |
| CH3 · NH · CH2 · CH2 · NH2 | pojmenování ligandu: N-methylethylendiamin |
c) ionizační izomerie:
Komplex má zaměněny ionty v koordinační a kompenzační sféře. Sloučeniny odlišíme názvem podle pravidel pro pojmenování koordinačních sloučenin.
Příklad:
| [Co(NH3)5SO4]Br | bromid pentaamo-sulfatokobaltitý |
| [Co(NH3)5Br]SO4 | síran pentaamo-bromokobaltitý |
d) koordinační izomerie:
Komplexy mající současně koordinační kation i koordinační anion se liší rozdělením ligandů mezi koordinační sféry obou centrálních atomů. Sloučeniny odlišíme názvem podle pravidel pro pojmenování koordinačních sloučenin.
Příklad:
| [Pt(NH3)4][CuCl4] | tetrachloroměďnatan tetraamoplatnatý |
| [Cu(NH3)4][PtCl4] | tetrachloroplatnatan tetraamoměďnatý |
4.2.6.2 Prostorová izomerie
Prostorová izomerie je podmíněna prostorovým uspořádáním ligandů v koordinační sféře centrálního atomu. Rozlišujeme geometrickou a optickou izomerii.
a) geometrická izomerie:
Nejčastěji se geometrická izomerie vyskytuje u čtvercových a oktaedrických komplexů.
U tetraedrických komplexů z geometrických důvodů existovat nemůže.
K rozlišení izomerů, z nichž každý má dvojici stejných ligandů, používáme strukturní předpony „cis-“ (stejné skupiny jsou u sebe) a „trans-“ (stejné skupiny jsou naproti sobě).
Příklady:
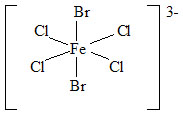 |
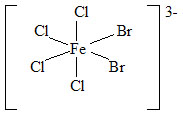 |
| trans-dibromo-tetrachloroželezitanový anion | cis-dibromo-tetrachloroželezitanový anion |
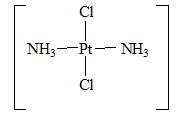 |
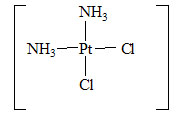 |
| trans-diamo-dichloroplatanatý komplex | cis-diamo-dichloroplatanatý komplex |
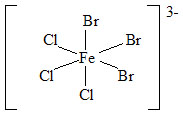
U komplexů nesoucích dvě trojice stejných ligandů se používají strukturní předpony „fac-“ (tři stejné ligandy obsazují vrcholy jedné strany oktaedru) a „mer-“ (tři stejné ligandy jsou umístěny na „poledníku“ oktaedru).
Příklady:
 |
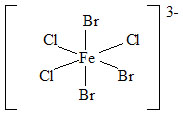 |
| fac-tribromo-trichloroželezitanový anion | mer-tribromo-trichloroželezitanový anion |
Tam, kde strukturní předpony nepostačují, používá se polohových indexů (tzv. lokantů), které se píší malými latinskými písmeny a tisknou kurzivou.
Příklad:
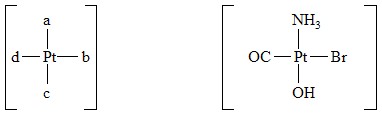 |
| a-amo-b-bromo-c-hydroxo-d-karbonylplatnatý komplex |
Pravidla pro používání polohových indexů jsou poměrně složitá a jejich podrobnější rozbor přesahuje rámec tohoto studijního materiálu.
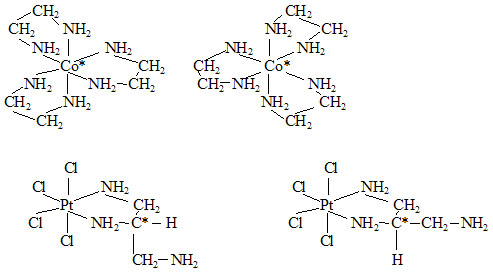
b) Optická izomerie
Je způsobena buď chirálním (asymetrickým) uspořádáním ligandů v koordinační sféře (převážně u chelátů) nebo chiralitou některého ligandu. V názvosloví se využívá polohových indexů používaných na základě poměrně složité soustavy pravidel, jejichž výklad přesahuje rámec tohoto studijního materiálu.
Příklady dvojic optických izomerů koordinačních sloučenin (asymetrické centrum je značeno hvězdičkou):
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
