3.2.3 Názvosloví anorganických kyselin
Kyseliny jsou (podle Arrheniovy a Brönstedovy teorie) sloučeniny, které jsou schopny při chemických reakcích uvolňovat proton. Obvykle jsou rozdělovány podle přítomnosti kyslíkového atomu v jejich molekulách na bezkyslíkaté a kyslíkaté.
3.2.3.1 Bezkyslíkaté kyseliny
Bezkyslíkaté kyseliny, stejně jako jejich soli, patří většinou mezi sloučeniny binární. V kapitole ternárních sloučenin jsou uváděny pro celistvost výkladu o kyselinách.
Obecný vzorec bezkyslíkatých kyselin je HmX (H – symbol atomu vodíku, X – obecný symbol kyselinotvorného prvku, popř. vzorce skupiny prvků). Jejich názvy se tvoří z podstatného jména kyselina a z přídavného jména vytvořeného z názvu odpovídající sloučeniny s vodíkem přidáním koncovky -ová, neboť bezkyslíkaté kyseliny většinou vznikají rozpouštěním některých plynných sloučenin vodíku ve vodě. Vzorce bezkyslíkatých kyselin jsou proto totožné se vzorci původních sloučenin.
Uvedené binární sloučeniny můžeme nazvat kyselinami jen tehdy, pokud jde o jejich vodné roztoky.
Příklady:
| čistá látka | vodný roztok této látky (tj. kyselina) | ||
| vzorec | název | vzorec rozpuštěné látky | název kyseliny |
| HF | fluorovodík | HF | kyselina fluorovodíková |
| HCl | chlorovodík | HCl | kyselina chlorovodíková |
| HBr | bromovodík | HBr | kyselina bromovodíková |
| HCN | kyanovodík | HCN | kyselina kyanovodíková |
| H2S | sulfan (dříve sirovodík) | H2S | kyselina sulfanová (dříve sirovodíková) |
3.2.3.2 Jednoduché kyslíkaté kyseliny (oxokyseliny)
Jejich obecný vzorec je HmXxOn (H – symbol atomu vodíku, X – obecný symbol kyselinotvorného prvku nebo centrálního atomu, O – symbol atomu kyslíku, indexy m, x, n, nabývají hodnot přirozených čísel).
Je-li počet atomů kyselinotvorného prvku nebo centrálního atomu oxokyseliny roven jedné (tj. x = 1), označují se jako jednoduché a jejich obecný vzorec lze vyjádřit HmXOn.
Příklady:
H2SO3 – kyselina siřičitá, HNO3 – kyselina dusičná, HClO4 – kyselina chloristá.
Názvy jednoduchých oxokyselin se skládají z podstatného jména kyselina a přídavného jména odvozeného od kyselinotvorného prvku přidáním koncovky, která vyjadřuje velikost hodnoty jeho oxidačního čísla.
Příklady určení oxidačního čísla centrálního atomu jednoduchých oxokyselin:
| HIMnzO4–II 1 · 1+ 1 · z + 4 · (–2) = 0 1 + z – 8 = 0 z = 8 – 1 z = 7 oxidační číslo kyselinotvorného prvku (manganu) je z = 7, odpovídající koncovka je „-istá“ => kyselina manganistá |
H2ICrzO4–II 2 · 1 + 1 · z + 4 · (–2) = 0 2 + z – 8 = 0 z = 8 – 2 z = 6 oxidační číslo kyselinotvorného prvku (chromu) je z = 6, odpovídající koncovka je „-ová“ => kyselina chromová |
Při odvozování vzorců jednoduchých oxokyselin je třeba určit počet atomů vodíku a kyslíku v molekule. Počet atomů vodíku souvisí s oxidačním číslem kyselinotvorného prvku nebo centrálního atomu. Je-li oxidační číslo sudé, zapisujeme dva atomy vodíku, je-li liché, zapisujeme jeden atom vodíku. Počet atomů kyslíku lze vypočítat.
Příklady stanovení počtu atomů kyslíku ve vzorcích jednoduchých oxokyselin:
| kyselina bromná HIBrIOn–II 1 · 1 + 1 · 1 + n · (–2) = 0 1 + 1 – 2n = 0 n = 1 => HBrO |
kyselina siřičitá H2ISIVOn–II 2 · 1 + 1 · 4 + n · (–2) = 0 2 + 4 – 2n = 0 n = 3 => H2SO3 |
Tvoří-li centrální prvek v témže oxidačním čísle dvě nebo více jednoduchých oxokyselin, používá se ke zpřesnění jejich názvu číslovkové předpony vyjadřující počet vodíkových atomů (hydrogen-, dihydrogen-, trihydrogen-, tetrahydrogen-, apod.) nebo počet kyslíkových atomů (oxo,dioxo, trioxo-, tetraoxo-, atd.). Označení „mono“ se neuvádí.
Příklady:
| HPO3 | kyselina hydrogenfosforečná | trioxofosforečná |
| H3PO4 | kyselina trihydrogenfosforečná | tetraoxofosforečná |
| HIO4 | kyselina jodistá | kyselina tetraoxojodistá |
| H3IO5 | kyselina trihydrogenjodistá | kyselina pentaoxojodistá |
| H5IO6 | kyselina pentahydrogenjodistá | kyselina hexaoxojodistá |
| HReO4 | kyselina rhenistá | kyselina tetraoxorhenistá |
| H3ReO5 | kyselina trihydrogenrhenistá | kyselina pentaoxorhenistá |
K označení některých kyselin se dosud používají odlišně utvořené názvy.
Příklady:
HOCN |
kyselina kyanatá |
H2S2O6 |
kyselina dithionová |
HNCO |
kyselina isokyanatá |
H2SxO6 (x = 2 – 6) |
kyselina polythionová |
H2NO2 |
kyselina nitroxylová |
H2S2O4 |
kyselina dithioničitá |
Upouští se od názvů kyselin s použitím předpon meta- a ortho-, kdy předpona meta- se používá u kyselin tvořených blíže nevyčíslenými bloky molekul, zatímco předpona ortho- znamená, že počet molekul tvořících kyselinu je přesně znám.
Příklady:
| (HBO2)x | kyselina metaboritá |
| H3BO3 | kyselina orthoboritá |
| (HPO3)x | kyselina metafosforečná |
| H3PO4 | kyselina orthofosforečná |
| (H2SiO3)x | kyselina metakřemičitá |
| H4SiO4 | kyselina orthokřemičitá |
Rovněž se nedoporučuje dříve používaná předpona pyro-, označující v zastaralé chemické literatuře kyseliny vytvořené ze dvou molekul kyseliny vystoupením jedné molekuly vody.
Příklady:
| vzorec kyseliny | zastaralý název dnes nepoužívaný | název podle současného chemického názvosloví |
| H4P2O7 | kyselina pyrofosforečná | kyselina difosforečná |
| H2S2O7 | kyselina pyrosírová | kyselina disírová |
| H2S2O5 | kyselina pyrosiřičitá | kyselina disiřičitá |
Pro některé kyseliny se kromě systematických názvů dosud používají i názvy triviální.
Příklady:| vzorec | triviální název | chemický název |
| H2SO4 | vitriol | koncentrovaná kyselina sírová |
| HNO3:HCl (1:3) | lučavka královská | směs kyseliny dusičné a kyseliny chlorovodíkové v poměru 1:3 (objemy komerčních koncentrovaných roztoků) |
| oleum, dýmavá kyselina sírová | 25 až 65-procentní roztok oxidu sírového v 98-procentní kyselině sírové |
|
| H2S2O8 | kyselina persírová | kyselina peroxodisírová |
3.2.3.3 Polykyseliny
Názvosloví polykyselin, tj. oxokyselin, které ve svých molekulách obsahují dva nebo více centrálních atomů (x = 2, 3, 4, 5, …), je založeno na stejném principu jako názvosloví jednoduchých oxokyselin. Názvy se skládají z podstatného jména kyselina a přídavného jména odvozeného od aniontu polykyseliny (se zakončením „–ová“), jejichž názvy byly podrobně diskutovány v kapitole 2.4.2.
Způsob odvození vzorců a názvů polykyselin uvádí následující příklady:
| odvození vzorce polykyseliny: kyselina dihydrogen dichromová |
odvození názvu polykyseliny: H5IP3zO10-II |
| H2ICr2VIOn-II | 5 · 1 + 3 · z + 10 · (–2) = 0 |
| 2 · 1 + 2 · 6 + n · (–2) = 0 | 5 + 3z – 20 = 0 |
| 2 + 12 – 2n = 0 | z = 5 |
| n = 7 | |
| H2Cr2O7 | kyselina pentahydrogentrifosforečná (dekaoxotrifosforečná) |
Další příklady:
| H6Si2O7 | kyselina hexahydrogendikřemičitá (k. heptaoxodikřemičitá) |
| H6W6O21 | kyselina hexahydrogenhexawolframová (k. 21-oxohexawolframová) |
| H2(Mo2VMo4VIO18) | kyselina dihydrogendimolybdeničnano-tetramolybdenová kyselina 18-oxodimolybdeničnano-tetramolybdenová |
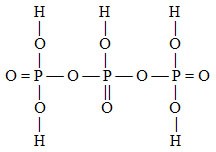 |
H5P3O10 kyselina katena-trifosforečná |
 |
H2Cr2O7 kyselina dichromová |
| kyselina katena-chromano-arseničnano-fosforečná | |
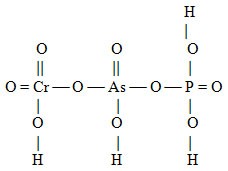 |
strukturní vzorec |
| H4(O3CrVIOAsVO2OPVO3) | funkční vzorec |
| H4 (CrVIAsVPVO10) | molekulový vzorec |
| kyselina cyklo-arseničnano-chromano-sírano-fosforečná | |
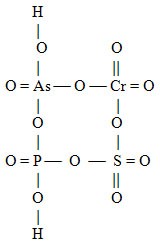 |
strukturní vzorec |
| H2(OAsVO2OCrVIO2OSVIO2OPVO2) | funkční vzorec |
| H2(AsVCrVISVIPVO12) | molekulový vzorec |
3.2.3.4 Deriváty oxokyselin
Deriváty oxokyselin se odvozují od oxokyselin náhradou jednoho nebo více atomů oxokyseliny za jiný atom nebo skupinu atomů.
- a) Názvy halogenidů se tvoří v souhlasu s názvy atomových skupin (viz kapitola 2.4.3), jež se obvykle vyjadřují v genitivu.
Příklady:
| NOBr | bromid nitrosylu |
| SOF4 | tetrafluorid thionylu |
| PSCl3 | trichlorid thiofosforylu |
Není-li možno u halogenderivátů použít názvu atomové skupiny, označujeme tyto sloučeniny jako halogenid-oxidy.
Příklady:
| XeF2O | difluorid-oxid xenoničitý |
| BiOCl | oxid-chlorid bismutitý |
- b) Názvy amidů kyselin se tvoří rovněž pomocí názvů atomových skupin nebo připojením názvu amid před název příslušné kyseliny vyjádřené v genitivu. Počet atomových skupin se vyjaduje číslovkovou předponou.
Příklady:
| SO2(NH2)2 | diamid sulfurylu nebo diamid kyseliny sírové (sloučenina je odvozena náhradou dvou OH skupin dvěma skupinami NH2, název atomové skupiny SO2 je sulfuryl) |
| PO(NH2)3 | triamid fosforylu nebo triamid kyseliny fosforečné (sloučenina je odvozena náhradou tří OH skupin třemi skupinami NH2, název atomové skupiny PO je fosforyl) |
- c) Obdobně se tvoří i názvy imidů, nitridů, hydrazidů a hydroxylamidů, které vznikají náhradou OH skupin těmito skupinami:
- imido (= NH),
- nitrido (N),
- hydrazido (–NH–NH2),
- hydroxylamido (– NH2O).
| NH(SO3H)2 | kyselina imido-bis(sírová) |
| N(SO3H)3 | kyselina nitrido-tris(sírová) |
| NH2NH · SO3H | kyselina hydrazidosírová |
- d) Estery anorganických kyselin vznikají reakcí kyseliny s alkoholem za vzniku esteru a vody. Přitom z molekuly kyseliny se odštěpí skupina OH– a z molekuly alkoholu se odštěpí kation H+.
- Názvy esterů anorganických kyselin se tvoří opisem připojením názvu ester před název oxokyseliny vyjádřený v genitivu. Slovu ester předřazujeme název alkylu (např. CH3 – methyl, C2H5 – ethyl, C3H7 – propyl, C4H9 – butyl, …) vzniklého odtržením OH skupiny od reagujícího alkoholu. Počet těchto skupin se vyjadřuje číslovkovou předponou.
Příklady odvození názvů esterů:
| H2SO4 | kyselina sírová | HSO3+ | jednovazný zbytek kyseliny sírové, tvořící část esteru | (CH3O)SO3H | methylester kyseliny sírové |
| CH3OH | methanol | CH3O- | zbytek methanolu, tvořící část esteru |
||
| CH3– | methyl | ||||
| SO22+ | dvojvazný zbytek kyseliny sírové, tvořící část esteru | (C2H5O)2SO2 | diethylester kyseliny sírové | ||
| C2H5OH | ethanol | C2H5O- | zbytek ethanolu, tvořící část esteru | ||
| C2H5– | ethyl | ||||
| H3BO3 | kyselina boritá | B3+ | trojvazný zbytek kyseliny borité, tvořící část esteru | (C4H9O)3B | tributylester kyseliny borité |
| C4H9OH | buthanol | C4H9O- | zbytek butanolu, tvořící část esteru | ||
| C4H9– | butyl |
- e) Peroxokyseliny vznikají od oxokyselin záměnou atomu O2– za skupinu O22–. Názvy peroxokyselin se tvoří připojením předpony „-peroxo“ k názvu oxokyseliny a doplněním číslovkové předpony označující počet peroxoskupin.
Příklady:
| HNO3 | kyselina dusičná | HNO2(O2) HNO4 NO2(OOH) |
kyselina peroxodusičná | ||
| H2SO4 | kyselina sírová | H2SO3(O2) H2SO5 HSO3(OOH) |
kyselina peroxosírová | ||
| H2SO2(O2)2 H2SO6 SO2(OOH)2 |
kyselina diperoxosírová |
- f) Thiokyseliny vznikají od oxokyselin záměnou atomu O2– za atom S2–. Názvy thiokyselin se tvoří připojením předpony „-thio“ k názvu příslušné oxokyseliny a doplněním číslovkové předpony označující počet thioskupin.
Příklady:
| H2SO4 | kyselina sírová | H2S2O3 | kyselina thiosírová | |
| H2S3O2 | kyselina dithiosírová | |||
| H2MoO4 | kyselina molybdenová | H2MoS2O2 | kyselina dithiomolybdenová | |
| HOCN | kyselina kyanatá | HSCN | kyselina thiokyanatá | |
| HNCO | kyselina isokyanatá | HNCS | kyselina isothiokyanatá | |
| H3AsO4 | kyselina arseničná | H3AsS4 | kyselina tetrathioarseničná | |
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
