Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Imortalizace buněk
Imortalizace buněk (možnost nekonečného dělení) zahrnuje inaktivaci specifických nádorově supresorových genů jako jsou pRB a p53, které se účastní regulace přechodu fáze G1-S buněčného cyklu a indukce apoptózy, i dalších genů spojených s těmito procesy. Kromě toho existuje v buňkách mechanizmus tzv. buněčné hodiny odpočítávající počet dělení a regulující stárnutí buňky. Normální somatická buňka má omezený počet dělení, tj. limitovanou schopnost proliferovat a nastává ireverzibilní zástava růstu, tzv. replikativní senescence. Gerontologický výzkum nedospěl ještě k vysvětlení složitosti stárnutí. Doba života je omezená a liší se obecně mezi druhy. Větší živočichové žijí obecně déle než menší. To naznačuje genetické vlivy a existuje řada teorií o změnách funkcí stadiem, kdy nedochází k dělení, tzv. Hayflickův limit nebo stadium smrti. Určité specifické geny mohou měnit délku života, ale zda také regulují stárnutí, zůstává otázkou.
Telomery
Telomery jsou vysoce konzervované nukleoproteinové komplexy přítomné na koncích chromozómů a obsahují tandemové opakující se sekvence DNA bohaté na guanin (TTAGGG) obalené specifickými proteiny vázajícími se na DNA. Telomery tvoří protektivní čepičku kolem genomové DNA a zabraňují chromozomálním ztrátám a aberantním fúzím během mitotického cyklu. Avšak u většiny lidských buněk se telomery zkracují úměrně počtu buněčných replikací a až dosáhnou kritické délky, buňka umírá. Jak buňka stárne, délka telomer se postupně zkracuje z asi 15 000 bp opakovaných sekvencí TTAGGG tak, že se ztrácí 25–200 bp při každém dělení. Zkracování telomer vybudí proliferativní stárnutí (senescence) a přes aktivaci kontrolních bodů pRB a p53 dochází u p53-divokých typů buněk k zástavě proliferace. Zatímco délka telomer koreluje s buněčným stárnutím, neexistují žádné důkazy pro jasnou korelaci na organizmální úrovni a korelace s délkou života člověka či jiných druhů.
Ztráta telomerických konců však může způsobit genomovou nestabilitu a změněnou genovou expresi. Tyto buňky procházejí krizovým stadiem nebo umírají. Dochází k bariéře v proliferaci charakterizované dysfunkcí telomer, extrémní genomovou nestabilitou a rozsáhlou smrtí buněk mechanizmy závislými i nezávislými na p53.
Tento mechanizmus je u nádorových buněk narušen aktivací genu kódujícího enzym telomerázu, který doplňuje telomerické segmenty, tak blokuje stárnutí a umožňuje buňce nekonečné dělení – imortalizaci (obr. 5-1). To má za následek jednak neomezený růst nádoru a jednak akumulaci dalších mutací, které zvyšují schopnost replikace, invaze a metastáz. U zdravých buněk až na specifické typy, jako jsou např. spermie, tento enzym není funkční.
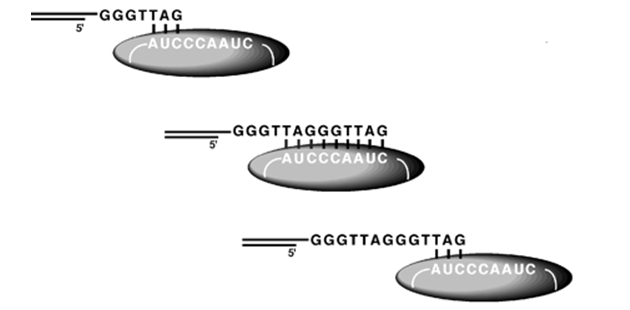
Obr. 5-1 Rozšiřování na guanin (G) bohatých telomerových vláken telomerázou
Imortalizace buněk
Imortalizované buňky vznikající z krizového stadia. Příčinou může být inaktivace p53 a pRB, zvýšená exprese onkogenů c-Myc a Ras a vážná genomová nestabilita. V těchto buňkách se obnovuje funkce telomer aktivací telomerázy, alternativním telomery udržujícím mechanizmem (ALT) nebo jiným adaptivním mechanizmem (obr. 5-2).
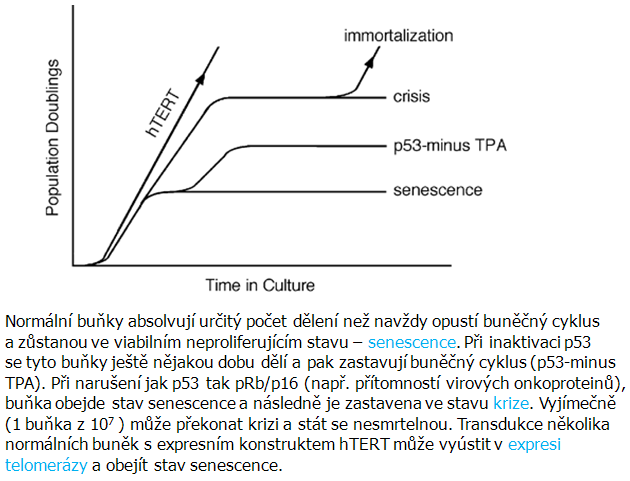
Obr. 5-2 Stadium terminální proliferační zástavy
Heterogenita průměrné délky telomer odráží genetické rozdíly a komplexní rovnováhu mezi procesy, které vedou k degradaci a těmi, které prodlužují telomery. Např. buňky se sebeobnovnou kapacitou mají delší telomery než diferencované buňky nebo telomery laboratorních myší jsou delší než u člověka. Telomery jsou kratší u lidských somatických tkání ze starších lidí než u mladších jedinců nebo u zárodečných buněk. Děti s genetickými nemocemi projevujícími se rychlým stárnutím tzv. progerickým syndromem (Down, Werner, Ataxia telangiectasia) umírají v raném věku s tělem devadesátiletých a jejich telomery jsou drasticky zkráceny.
Ve skutečnosti mají nádorové buňky kratší telomery než jejich odpovídající normální buněčné typy. Tyto telomery se dále zkracují během progrese nádoru a u myších experimentálních modelů jsou zkrácené telomery spojeny se zvýšenou genetickou nestabilitou a zvýšenou nebo redukovanou spontánní malignitou v závislosti na genetickém kontextu (obr. 5-3). Mnoho faktorů (genetických, nutričních, hormonálních, environmentálních, farmakologických) může modulovat udržování telomer a potenciál buněčného života.
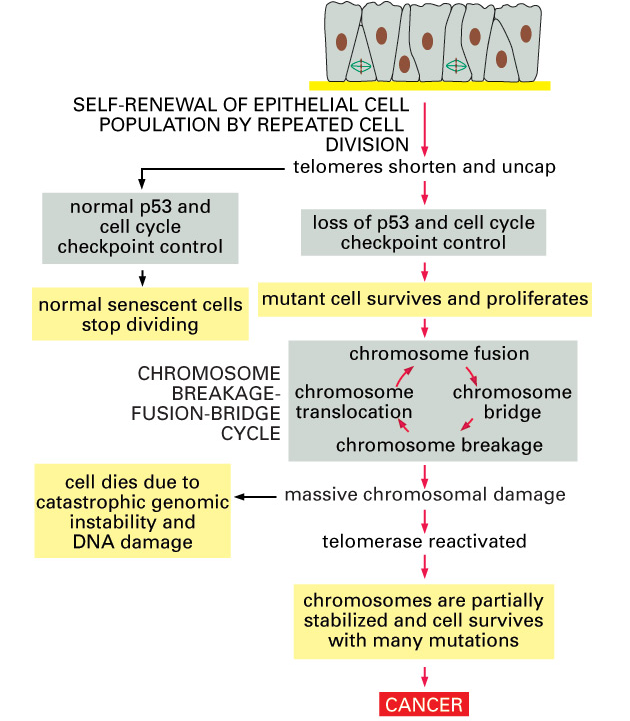
Obr. 5-3 Zkracování telomer může vést k chromozomální nestabilitě a vzniku nádoru
(Figure 23-36. Molecular Biology of the Cell, 4th Edition.)
Telomeráza
Telomery nejsou udržovány normálním replikačním procesem. U kmenových, nádorových a imortalizovaných buněk, je zkracování telomer zastaveno aktivací telomerázy – reverzní transkriptázy, která rozšiřuje telomerické opakované sekvence TTAGGG.
Obsahuje tři hlavní složky: s telomerázou spojený protein, TLP1, telomerázovou RNA -hTR a telomerázovou katalytickou jednotku TP2 – lidská telomerázová reverzní transkriptáza.
Telomeráza používá svou RNA k navázání na telomery, zatímco katalytická proteinová jednotka syntetizuje DNA přímo na koncích chromozómů reverzní transkripcí templátu RNA. Telomeráza je vysoce exprimována ve většině nádorů a kmenových buněk, středně v hyperplastických buňkách a velmi nízká nebo žádná v normálních diferencovaných tkáních. Postupně se také snižuje s věkem. Exprese telomerázy je spojena s vysokým proliferačním indexem a obnovným tkáňovým potenciálem, agresivitou nádorů, vysokým histopatologickým gradem a s proliferací cévního endotelu.
Telomerázová aktivace a zvýšená exprese je často nezbytným a raným dějem v mnohastupňové karcinogenezi. Vzrůstá rychle během chemické karcinogeneze a po zkrácení telomer. Telomeráza není ani onkogen ani nádorově supresorový gen, ale je regulována nahoru nebo dolů mnoha faktory a stává se důležitým predisponujícím dějem u karcinogeneze nebo cílené nádorové terapie.
Homeostáza systému telomery-telomeráza je komplexní a svázána s genetickými a environmentálními faktory.
Řada faktorů snižuje (diferenciační činidla, epigallocatechin gallate z čaje, antineoplastické látky – cisplatina, doxorubicin, protein fosfatáza 2, MAPK, tamoxifen, androgeny, volné radikály, inhibitory reverzní transkriptázy) a řada látek zvyšuje telomerázovou aktivitu (chemické karcinogeny, mutace telomerických sekvencí, gamma záření, PKC, EGF, estrogeny).
Vztahy mezi telomerázovou aktivitou a nádorovým onemocněním jsou složité a jen částečně objasněné. Telomeráza může paradoxně buď podporovat, nebo inhibovat tvorbu nádorů v závislosti na genetickém kontextu (obr. 5-4).
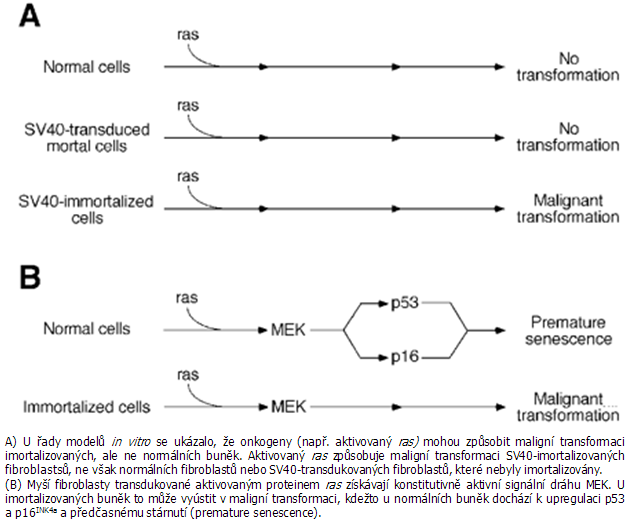
Obr. 5-4 Imortalizace je nutná, ale ne dostačující pro maligní transformaci
U nádorových buněk jsou telomery kratší a telomerázová aktivita obvykle následuje po zkracování telomer. Ztráta funkce telomer při raném dělení zahajuje genetickou nestabilitu, zatímco v pozdějším bodě progrese nádoru absence telomerázy inhibuje růst. Tak zatímco inhibice telomerázy u ustanovených nádorů může být cenným terapeutickým přístupem, na věku závislé zkracování telomer může být rizikovým faktorem pro nádory tím, že umožňuje obejít kontrolní bod mortality.
Ukázalo se, že např. u epiteliálních buněk a fibroblastů musí být narušeny nejméně 4 signální dráhy: odpověď na mitogeny aktivací ras, udržení aktivní telomerázy, inaktivace pRB a p53. Tak se ukazuje, že aktivace telomerázy je zásadním dějem v mnohastupňové karcinogenezi, tvorbě prekarcinogenních buněk, nádorových buněk a je považována za znak nádorových buněk. Avšak důležitost dysfunkce telomer pro imortalizaci a tumorigenezi je komplexní a jen částečně objasněna.
Faktory ovlivňující imortalizaci
Systém telomery-telomeráza představuje komplexní skupinu molekul interagujících navzájem a modulujících věk buněk, genetickou stabilitu a nádorovou transformaci. Vnější zásahy mohou modulovat žití zvyšováním nebo snižováním délky života, ale s tímto přístupem jsou spojeny také odpovídající problémy. Udržování telomer by mohlo být důležité pro prodloužení života, ale vzhledem ke složitosti fyziologických mechanizmů na buněčné a zejména organizmální úrovni, nelze tento problém zjednodušovat. Z onkologického hlediska, může vyšší exprese telomerázy zvyšovat riziko vzniku nádorů. Ačkoliv normální buňky s delší dobou života a udržovanými telomerami se nejeví jako neoplastické, zpoždění fyziologické smrti může zvyšovat pravděpodobnost kontaktu s karcinogeny. Telomeráza sama také podporuje onkogenní potenciál predisponovaných buněk a je cílem protinádorových terapií (obr. 5-5 a 5-6).
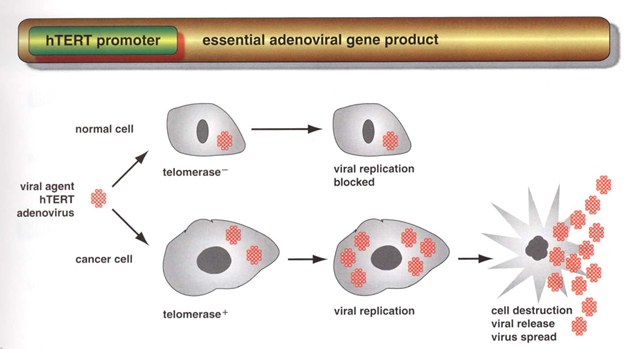
Obr. 5-5 Adenovirová terapie využívající promotoru pro telomerázu selektivně usmrcuje nádorové buňky
(Shay J.W. and Wright W.E., Cancer Cell 2002 : 257)
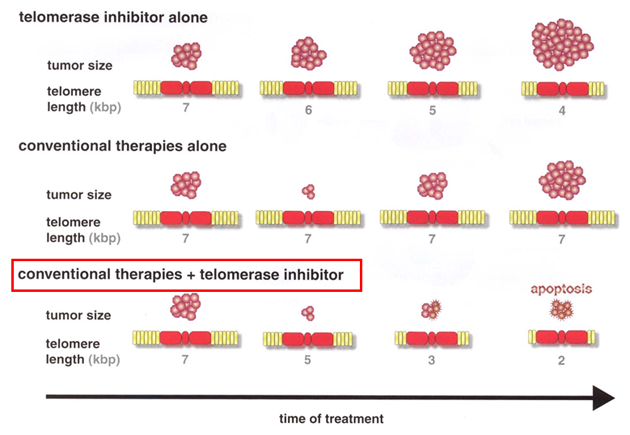
Obr. 5-6 Inhibitory telomerázy a konvenční terapie
(Shay J.W. and Wright W.E., Cancer Cell 2002 : 257)
Zatím se pozornost soustřeďuje na zvýšení doby života několika cílových buněk nebo snížení proliferujících nádorových buněk. Málo pozornosti je věnováno organizmální úrovni, mikro- a makroprostředí, ve kterém tyto buňky rostou jako normální nebo imortalizované nádorové buňky, tj. angiogenezi, růstovým a diferenciačním faktorům, cytokinům, hormonům, imunitnímu systému a environmentálním faktorům.
Na závěr se nabízí otázky, na které není lehké najít odpověď:
- Je bezpečné prodlužovat lidský život použitím terapeutických látek?
- Je lepší prodlužovat lidský život nebo zlepšovat kvalitu života?
Kontrolní otázky k tématu
- V čem spočívá imortalizace buněk?
Co jsou to telomery, telomeráza a jak fungují u nádorových buněk?
Které faktory mohou ovlivnit telomerázovou aktivitu a jaký význam má její snížení (zvýšení).
Jak přispívá zkracování telomer ke vzniku nádorů?
Jak jsou poznatky o mechanizmech fungování systému telomery-telomeráza využívány v terapii?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

