Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Prevence, diagnostika a léčba nádorových onemocnění
Prevence
Obecně je prevence (předcházení) onemocnění považována za nejlepší způsob boje s chorobami. Nezanedbatelný je také ekonomický aspekt, zejména tam, kde je léčba velmi drahá a ne vždy zcela úspěšná, což jsou právě nádorová onemocnění. Prevencí se omezuje incidence (výskyt) onemocnění, léčbou pak lze snížit úmrtnost na dané onemocnění (obr. 16-1).
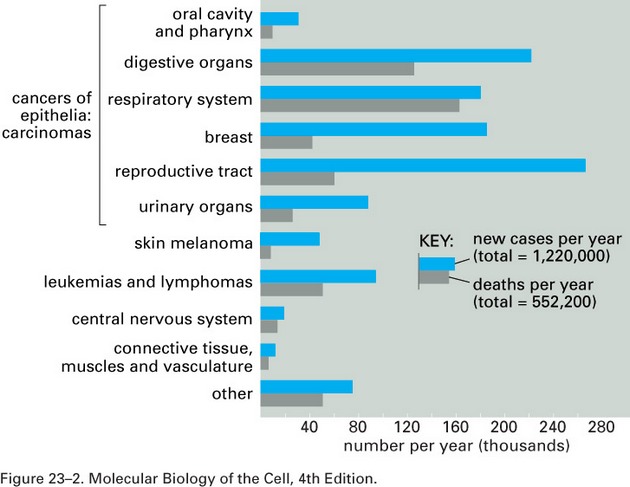
Obr. 16-1 Incidence a úmrtnost na nádorová onemocnění (USA)
(Figure 23-2. Molecular Biology of the Cell, 4th Edition)
K tomu, abychom mohli provádět preventivní opatření a vyloučit faktory, které způsobují nebo přispívají ke vzniku onemocnění, je nutné zkoumat a odhalovat konkrétní mechanizmy vzniku a rozvoje těchto nemocí. S nárůstem poznatků o genetických i negenetických faktorech souvisejících s nádorovým onemocněním se rozšiřují rovněž možnosti prevence. Ta spočívá jednak v identifikaci genetických abnormalit, zejména dědičných, souvisejících s určitými typy nádorových onemocnění a podchycení jedinců náchylných k onemocnění. Na základě cytogenetických analýz nebo např. enzymových markerů se vytvářejí a vyhodnocují tzv. „family trees“ (obr. 16-2).
Obr. 16-2 Dědičnost nádorových onemocnění
Mutace specifických genů způsobují zvýšenou náchylnost (susceptibility) k určitým typům nádorů. Důležité jsou rodinné anamnézy („family trees“).
Od toho se odvíjí rovněž vyloučení faktorů vnějšího prostředí a životního stylu, které by mohly vznik a rozvoj podporovat, jak u náchylných tak normálních jedinců. K nejzávažnějším patří zejména kouření, nezdravá strava, nedostatek pohybu, expozice chemickým látkám či záření (ionizující i UV). Existuje také řada faktorů a látek, které mohou aktivně působit proti onemocnění, např. fyzická aktivita a zdravá strava obsahující prospěšné látky.
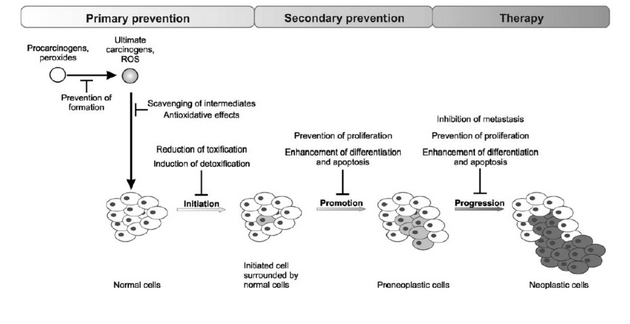
Primární prevence inhibuje iniciaci buněk redukcí toxicity nebo indukcí detoxifikace. Sekundární prevence redukuje přeměnu iniciovaných buněk v preneoplastické supresí proliferace nebo indukcí diferenciace nebo apoptózy. Terapie se potom zaměřuje na omezení rozvoje onemocnění do progresivního stadia (obr. 16-3).
Na využití znalostí o prospěšném působení některých látek je založena chemoprevence (obr. 16-4). Jedná se o přírodní, ale i syntetické látky zasahující v raných fázích karcinogeneze. Mnoho z těchto sloučenin je obsaženo především v ovoci a zelenině. Laboratorní a epidemiologické studie u nich prokázaly např. schopnost aktivovat detoxifikační enzymy, antioxidační účinky, ale i řadu dalších mechanizmů.
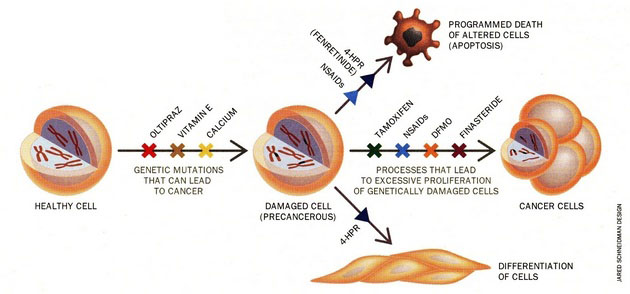
Obr. 16-4 Chemoprevence a chemoterapie
(Greenwald P., Scientific American 1996 : 96)
K přirozeným látkám patří α-tokoferol, β-karoten, vitamin A a retinoidy (zelenina, ovoce), dithiolthiony a sulforaphan (brokolice, květák, kapusta), genistein (sója), epigallocatechine gallate (zelený čaj), curcumin (kari), polyfenoly (tmavé bobuloviny – ostružiny, borůvky, černý rybíz), lykopen (rajčata), resveratrol (červené víno) i látky obsažené v česneku. K uměle syntetizovaným chemopreventivním sloučeninám patří např. tamoxifen – antiestrogen – hojně využívaný v prevenci u žen se zvýšeným rizikem vzniku nádoru prsu. Finasterid, který blokuje přeměnu testosteronu na androgen, působí preventivně u nádorů prostaty. DFMO (difluorometylornitin) blokuje aktivitu ornitin dekarboxylázy a působí preventivně u různých typů nádorů. Širokou skupinu látek s různými účinky tvoří protizánětlivé nesteroidní látky (NSAID) jako jsou aspirin, indometacin, diclofenac, piroxicam, sulindac a další, z nichž některé jsou využívány pro prevenci rozvoje kolorektálních nádorů. Patří k nim inhibitory cyklooxygenáz (COX) zejména selektivní inhibitory COX-2. Na základě znalostí mechanizmů působení jsou využívány i ligandy různých vnitrobuněčných receptorů např. ligandy receptorů pro retinoidy (RXR, RAR) nebo pro peroxisomové proliferátory (PPAR). Stále jsou také vyhledávány nové možnosti na základě strukturálních studií (obr. 16-5).
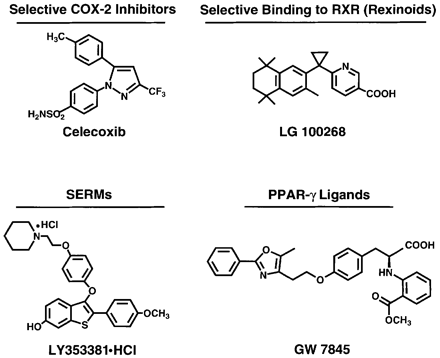
Obr. 16-5 Příklady syntetických chemopreventivních látek
Diagnostika
Na základě vědeckých poznatků a rozvoje technologií se rozvíjí rovněž možnosti včasné diagnostiky nádorových onemocnění.
Kromě laboratorních vyšetření (sedimentace erytrocytů, hematologické vyšetření, biochemická vyšetření) je dnes již známá celá řada tzv. nádorových markerů (tumor markers, TM) (obr. 16-6).
Obr. 16-6 Biochemická klasifikace nádorových markerů (TM)
- Humorální TM (detekovatelné v tělních tekutinách)
- onkofetální antigeny (CEA, AFP, CA 15–3 atd.)
- enzymy (PSA, NSE, TK, LD atd.)
- hormony (hCG, PRL, PTH, ADH atd.)
- plazmatické proteiny (ferritin, β2M, paraproteiny aj.)
- ostatní (HIAA, VMK atd.)
- Buněčné TM (ER,PR, HER2/neu atd.)
- Genetické TM (ATM, BRCA1/2, p53, Rb1 atd.)
Jsou to laboratorně prokazatelné známky, od kterých se nádorové bujení odvíjí (onkogeny, nádorově supresorové geny) nebo kterými se nádorové onemocnění projevuje (nádorové antigeny, produkty nádorových buněk nebo reaktivní produkty nenádorových buněk). V užším (klinickém) slova smyslu představují látky stanovitelné v krvi, moči nebo tkáni, které mají vyšší hodnotu u nádorových onemocnění. Jsou používané k zpřesnění diagnózy, sledování průběhu terapie a časnému záchytu relapsu onemocnění. Mohou být produkovány přímo buňkami nádoru nebo buňkami nenádorovými v reakci na přítomnost nádoru, ale mohou být někdy zvýšeny i z nenádorových příčin.
Nádorové markery můžeme dělit podle místa produkce, specifičnosti, chemické struktury a biologického charakteru. Existuje řada rutinně používaných nádorových markerů (CA 15-3, CEA, proliferační a cytokeratinové markery), stejně jako těch, jejichž prognostický a prediktivní význam v séru je předmětem diskuse (HER-2/Neu, uPA, PAI-1, metaloproteinázy a jejich inhibitory apod.). Detaily existují v doporučeních odborných společností European Group on Tumor Markers (EGTM), American Society of Clinical Oncology (ASCO) a National Academy of Clinical Biochemistry (NACB).
Nádorově specifické markery souvisí s přítomností určité nádorové tkáně. Vzhledem k tomu, že se produkce TM u různých nádorových tkání značně překrývá, je specifita nízká. Jsou vhodné ke sledování remise nádorového onemocnění a časné diagnózy relapsu onemocnění: např. CEA (karcinom gastrointestinálního traktu – GIT); CA19–9 (karcinom pankreatu); CA125 (karcinom ovárií) aj.
Tkáňově specifické nádorové markery souvisí spíše s určitou tkání, ve které může probíhat patologický děj (např. růst nádoru). Často bývají zvýšeny z nenádorových příčin (např. PSA u mužů – prostata; HCG a AFP – zárodečná ev. jaterní tkáň).
Příklady nádorových markerů:
Název CA je odvozen z komerčních setů pro jeho určování (carbohydrate antigen) hlavně z nádorů žlázového epitelu a epitelu mléčné žlázy.
- CA 15-3: zvýšen u karcinomu prsu – senzitivita 75 %, specifita 90 %, některé nádory GIT. Falešná pozitivita možná u hepatopatií, cholangoitidy, plicních nemocí, renálních poruch, gravidity.
- CA 19-9: zvýšen u karcinomu pankreatu, žaludku, prsu, kolorekta. Falešná pozitivita – obstrukční ikterus.
- CA 72-4: zvýšen u karcinomu žaludku, jícnu, plic a ovárií.
- CA 125: zvýšen u karcinomů ovárií a je využíván pro screening u žen s ovariálním karcinomem v rodinné anamnéze a sledování léčby karcinomu ovárií. Falešná pozitivita zjištěna u benigní afekce ovárií a endometria, hepatopatie, pankreatitidy, v těhotenství, během menstruace.
- SCCS (squamous cell carcinoma) antigen: je zvýšen u dlaždicobuněčných CA v různých lokalizacích
- TPA/S (tkáňový polypeptidový antigen): je směs asi 20 fragmentů cytokeratinů. Je to marker proliferace a jeho plazmatická hladina odpovídá růstu různých karcinomů (hlavně karcinom močového měchýře, hlavy a krku)
- CYFRA 21-1: fragmenty cytokeratinu 19 – specifičtější pro nemalobuněčný karcinom plic.
- Antigen mucinózních karcinomů (MCA): marker karcinomu prsu, jeho vzestup je dříve než CA 15-3. Užívá se jako potvrzení při zvýšeném CA 15-3.
Onkofetální antigeny:
- AFP: α-fetoprotein – zvýšen u nonseminomů, u ostatních germinálních nádorů (testikulární nádory, teratom) a u hepatocelulárního karcinomu (hCC), kde je až 95% senzitivita. Zvažuje se screeningové vyšetřování u rizikových skupin (cirhotici, hepatitida B aj.).
- CEA: karcinoembryonální antigen – zvýšen u nejčastějších typů nádorů (obr. 16-7)
Obr. 16-7 Karcinoembryonální antigen CEA
- rodina 36 glykoproteinů na povrchu membrán buněk řady orgánů ektodermálního původu, zejména GIT
- běžně vytvářen v epiteliálních buňkách během fetálního vývoje, ovlivňuje buněčnou adhezi, funkce není plně známa
- má nepřímý imunosupresní vliv na T lymfocyty
- poločas 7–14 dní
- norma do 3 mg/l u kuřáků do 5 mg/l
- může být zvýšen u cirhóz a u zánětů GIT
- produkce u kolorektálního, prsního, plicního a ovariálního karcinomu a metastatického postižení jater
- pokles CEA po 4. týdnu po zákroku svědčí o úspěchu
Enzymy
Klinicky signifikantní může být zvýšení enzymatické aktivity enzymů některého orgánu nebo nadprodukce fetálních enzymů
- PSA: prostatický specifický antigen – zvýšen u nádorů prostaty (obr. 16-8)
Obr. 16-8 PSA prostatický specifický antigen
- biochemicky se jedná o serinovou proteázu
- produkován normálními i nádorovými buňkami prostaty
- naprostá většina secernována do tekutiny produkované semennými váčky, kde přispívá ke zkapalnění ejakulátu
- zvýšen u karcinomu prostaty, ale i při/po jiných fyziologických/patofyziologických jednotkách (nejčastěji ejakulace, p.r. vyšetření před odběrem)
- referenční hodnoty stoupají s věkem (<2,5 μg/l< 50let; <5 μg/l 50-60let; 8,5< μg/l>60let)
- hodnoty nad 10 μg/l – 50% riziko karcinomu
- v plazmě přítomný jak volný PSA(fPSA) tak vázaný PSA, jejich součet se nazývá total PSA (tPSA) – poměr fPSA/tPSA usnadňuje diagnostiku → nad 25 % – pravděpodobně benigní léze; pod 10 % spíše maligní etiologie 10–25 % zóna překryvu
- asi 20 % ca prostaty má PSA v normě!!!
- NSE: neuron specifická enoláza – zvýšena u neuroblastomů, retinoblastomu, maligního melanomu, malobuněčného karcinomu plic.
- LD: zvýšen u testikulárních nádorů, leukemií
- ALP : zvýšen u sarkomů, karcinomů prostaty (prostatická frakce)
- GMT: zvýšen u metastatického postižení jater (obecně), u alkoholiků, obstrukce žlučovodů
- TK thymidinkináza představuje náhradní cestu syntézy DNA. Bývá zvýšena u leukemií, lymfomů, nemalobuněčných nádorů plic
Hormony
- hCG lidský choriový gonadotropin je placentárního původu s gonadotropními účinky. Zvýšen u tumorů trofoblastu, choriokarcinomu – 100 % senzitivita, germinálních nádorů testes a ovarií; těhotenství. Využití pro screening ohrožených osob.
Plazmatické proteiny
- Ferritin bývá zvýšen u mnohočetného myelomu, AML
- β2 mikroglobulin zvýšen u mnohočetného myelomu, CLL, lymfomů
Ostatní
- Kyselina vanilmandlová VMA je produkt degradace katecholaminů a stanovuje se v moči u funkčních nádorů nadledvin.
Buněčné nádorové markery
- HER2/neu se stanovuje u karcinomu prsu a jeho zvýšená exprese značí zvýšenou proliferační aktivitu a tak horší prognózu. Je cílem monoklonální protilátky trastuzumab (Herceptin), který se aplikuje na základě zjištěné HER2/neu pozitivity nádoru.
Genetické nádorové markery
Patří sem pro nádor charakteristické genetické změny jako jsou některé typické genové mutace či chromozomální abnormality.
- p53: "strážce genomu" nádorově supresorový gen regulující buněčný cyklus. Účastní se zástavy buněčného cyklu, reparace DNA a indukce apoptózy. Jeho mutace se vyskytují u více než 50% nádorů. Tzv. Li Fraumeni syndrom je zděděná mutace zodpovědná za zvýšený výskyt karcinomu prsu, sarkomů apod.
- BRCA 1 (breast cancer type 1 susceptibility protein) je marker karcinomů prsu a ovárií, odpovědný za reparaci DNA. První důkaz existence byl podán v r. 1990. BRCA1 je exprimován v buňkách prsu a jiných tkání, kde se účastní reparace DNA nebo likvidace buněk pokud DNA není reparována. Pokud je nefunkční, poškozená DNA není řádně reparována a tím roste riziko vzniku nádorů.
- BRCA2 (breast cancer type 2 susceptibility protein) protein je nacházen uvnitř buněk a gen patří do skupiny nádorově supresorových genů. Protein se účastní reparace chromozomálního poškození a má důležitou úlohu při bezchybné reparaci dvojitých zlomů v DNA.
Analýza exprese onkologických markerů
Nádorové buňky se od normálních zdravých buněk liší na molekulární úrovni svým expresním profilem, tj. že nádorová buňka exprimuje jiné geny ze své výbavy, což se projeví změnou množství a spektra exprimované mRNA. Vyšetřením exprese vybraných markerů lze určit základní diagnózu a přítomnost metastáz, tzn. určení typu, rozsahu neboli stupně pokročilosti nádorového onemocnění. Je k tomu využívána metoda polymerázové řetězové reakce v reálném čase (RT-PCR), pomocí níž se detekují nádorové buňky v primárním tumoru, v krvi, kostní dřeni či v lymfatickém systému pacienta. Tato metoda umožňuje zjistit nádorové buňky v koncentraci, která je hluboko pod detekčním limitem standardních vyšetřovacích metod (imunohistochemie, průtoková cytometrie aj).
Běžně používaná je řada biochemických metody detekce: radioimunologická (RIA), enzym vázající imunosorpční (ELISA). Ke stanovení jsou většinou využívány komerční kity a automatické analyzátory.
Součástí vyšetření bývá i cytologické a bioptické vyšetření (pre- nebo postoperační).
Důležité je rovněž vyšetření stavu buněčné kinetiky. Sledují se počty mitóz (mitotický index), apoptóza, syntéza DNA a jsou využívány různé metody od autoradiografických (inkorporace 3H-tymidinu), přes metody cytochemické (speciální barvení, speifické protilátky proti antigenům spojeným s proliferací jako je Ki-67, PCNA, stanovení AgNOR až k moderním metodám cytometrickým (fluorescenční a konfokální mikroskopie, průtoková cytometrie a sortování) a molekulárně biologickým (Southern, Nothern a Western blotting pro analýzu DNA, RNA a proteinů). Polymerázová řetězová reakce spočívá v amplifikaci malých fragmentů DNA, vytváření cDNA knihoven z malého množsví mRNA (PCR, RT-PCR), hybridizace in situ a „microarrays“.
K používaným zobrazovacím metodám patří ultrasonografie (vyšetření ultrazvukem, neinvazivní), rentgenové vyšetření (kontrastní vyšetření, mamografie – screening a diagnostika rakoviny prsu), magnetická rezonance (zejména vyšetření mozku a míchy). Počítačová tomografie (CT) je schopna odhalit 90 % ložisek menších než 1 cm. Radionuklidové vyšetřovací metody využívají izotopy (scintigrafie, emisní tomografie). Endoskopické vyšetření pak odhaluje nádory v tělních dutinách.
Klasifikace nádorových onemocnění
Určení rozsahu onemocnění je důležité pro volbu léčebné strategie a pro odhad prognózy onemocnění. Existuje jednotný klasifikační systém TNM:
- T (tumor) 1–4 – rozsah primárního nádoru
- N (noduli) 1–3, 0, X – stav regionálních mízních uzlin
- M (metastases) 0, 1 – informace o metastázách
Histopatologický grading G1–4, X označuje stupeň diferenciace.
Další nezávazné deskriptory jsou stadium choroby (staging) I.–IV. i hodnocení tělesné zdatnosti (funkční staging)
U některých nádorů je formulován soubor prognostických znaků, tzv. mezinárodní prognostický index (IPI).
Nádory jsou biologicky charakterizovány na různých úrovních:
- Klinické – staging (jeden z nejsilnějších prognostických faktorů), sledování přežití a léčebné odpovědi
- Orgánové – sledování odpovědi nádoru na léčbu
- Tkáňové – histologická charakteristika, grading, tkáňová architektonika, vaskularizace, expresní profily – imunohistochemie, in situ hybridizace
- Buněčná – funkční testy, obsah DNA, proliferační a apoptická aktivita
- Molekulární – cytogenetické a genetické charakteristiky nádorových a somatických buněk
Léčba
K základním léčebným metodám patří u nádorových onemocnění chirurgie (solidní nádory), ozařování, chemoterapie a nověji biologická terapie. V současné době se většinou používá jak kombinace těchto přístupů, tak kombinace různých léčiv.
K nejvyužívanějším chemoterapeutickým látkám patří:
- platinové deriváty
- antimetabolity (metotrexat, fluorouracil)
- inhibitory topoizomeráz (doxorubicin, etoposid)
- alkylační činidla (cyklofosfamid)
- rostlinné alkaloidy (vinblastin, paclitaxel)
Tyto látky působí na základě různých mechanizmů, z nichž mnohé jsou ještě předmětem výzkumu (obr. 16-9).
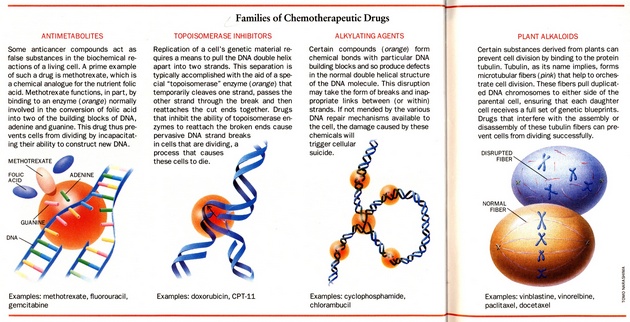
Obr. 16-9 Chemoterapeutické látky
Chemoterapeutika zabraňují množení buněk nebo indukují apoptózu různými mechanizmy. Antimetabolity, inhibitory topoizomeráz a alkylační činidla blokují syntézu DNA. Rostlinné alkaloidy blokují mitotické dělení. (Hellman S. and Vokes E.E., Scientific American 1996 : 118)
Biologická terapie je charakterizována hledáním nových přístupů na základě poznání mechanizmů. Jedná se o:
- Stimulace obranných mechanizmů hostitele včetně specifických a nespecifických imunologických přístupů (imunoterapie) (obr. 16-10).
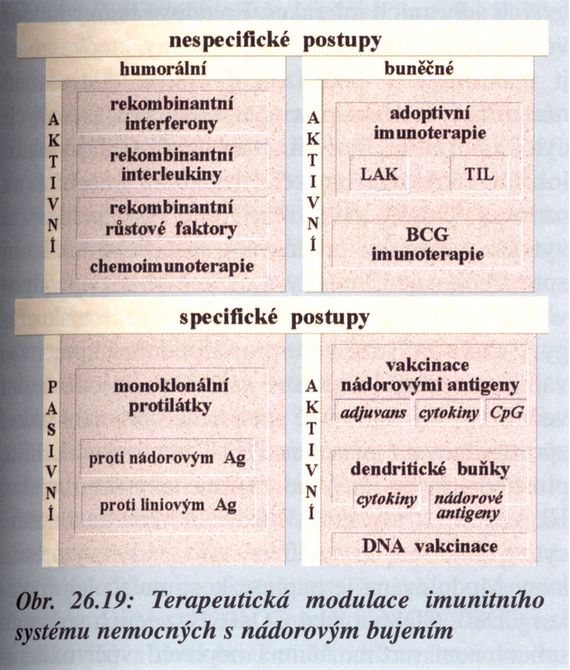
Obr. 16-10 Terapeutická modulace imunitního systému nemocných s nádorovým bujením
(Krejsek J. a Kopecký O., Klinická imunologie 2004) - Strategie cílené přímo na změnu nádorového růstu a diferenciace s využitím růstových faktorů a genetického inženýrství umožňujícího ovlivnění klíčových genů.
- Angiogenní terapie, která je cílená proti vaskularizaci nádorů atd.
Podpůrná (symptomatická) léčba nemá za cíl smrt nádorových buněk, ale usiluje o co nejlepší kvalitu života nemocných (zmírnění obtíží vyvolaných nádorem a léčbou)
Paliativní léčba je komplexní podpůrná léčba u pacientů s pokročilým nevyléčitelným onemocněním
Cílem kurativní léčby je vyléčení nemocného, kdežto cílem nekurativní léčby je sice zabíjení nádorových bunek, ale nemá ambice vyhubit všechny (z důvodů pokročilé fáze onemocnění, rezistence na léčbu atd.)
Adjuvantní léčebné postupy označují chemo- nebo radio-terapii u těch nádorů, kde je předpokládána přítomnost mikrometastáz. Nutným předpokladem je chemosenzitivita nádoru.
Neoadjuvantní postupy spočívají v předoperační léčbě s cílem zmenšit primární nádor před chirurgickým výkonem
Při léčbě radio- či chemoterapií se u nádorového onemocnění (nehemopoetického) často využívá autotransplantace. Spočívá v odběru zdravé kostní dřeně nebo krve a izolace kmenových buněk či progenitorů (někdy s podporou příslušných růstových faktorů). Po léčbě následuje zpětná transplantace pro obnovu krvetvorby (obr. 16-11).
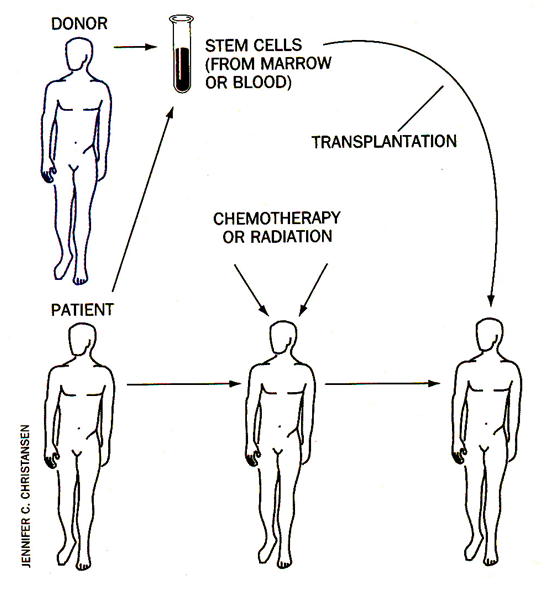
Obr. 16-11 Transplantace
(Christansen J.C., Scientific American 1996 : 124)
V budoucnu se na základě intenzívního výzkumu počítá rovněž s využitím transplantace různých typů tkánově specifických kmenových buněk (human stem cells – HSC) (obr. 16-12).
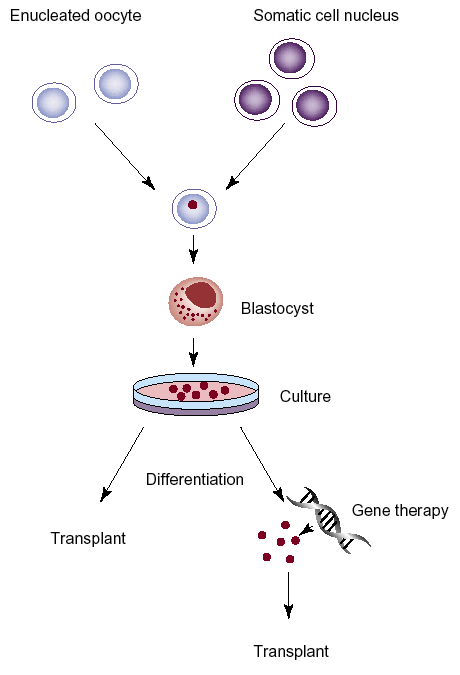
Obr. 16-12 Tvorba emryonálních kmenových buněk přenosem jádra somatické buňky do enukleovaného oocytu
Buňky získané z takto vytvořené blastocysty lze využít k transplantaci, příp. s využitím předchozí genové terapie k nápravě genetických poškození.
(Mayhall E.A. et al., Curr Opin Cell biol 2004 : 713)
Izolace HSC z kostní dřeně a následná transplantace umožňuje rekonstituci červené i bílé krevní řady u nádorů, imunologických deficiencí, metabolických poruch či hemoglobinopatií. Epiteliální buňky mohou být kultivovány a transplantovány jako autologní zdroj epiteliálních kmenových buněk u popálenin, vředů a genetických poruch kůže. Dopaminergní neurony odvozené od embryonální neurální tkáně mohou být transplantovány při Parkinsonově chorobě (obr. 16-13).
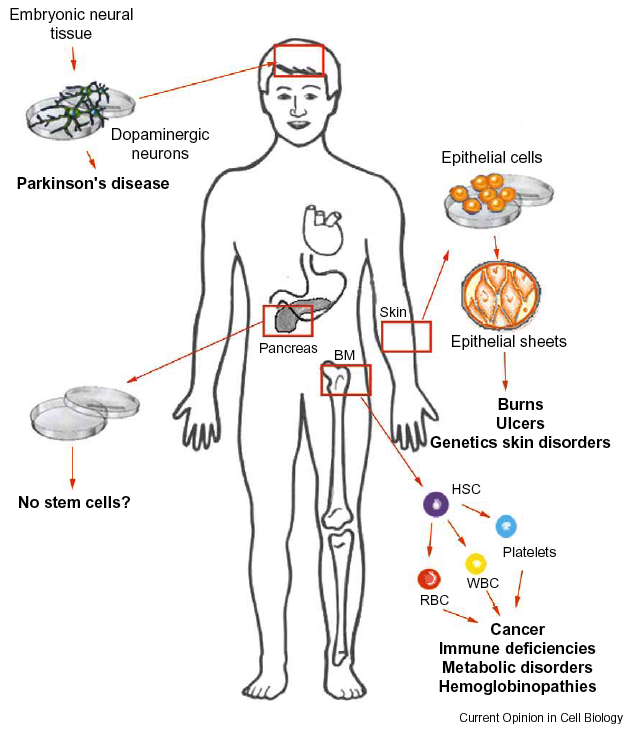
Obr. 16-13 Využití transplantace tkáňově specifických kmenových buněk
(Mayhall E.A. et al., Curr Opin Cell biol 2004 : 713)
Vznik a vývoj nádorů je složitý děj, který závisí na překonání řady restrikčních mechanizmů na úrovni genomu, buňky, tkáně i celého organizmu a který pro svou komplexnost vyžaduje při plánování terapie individuální přístup (tailoring therapy) na základě poznaných biologických charakteristik.
Incidence nádorových onemocnění se stále zvyšuje. Přesto je dlouhodobá mortalita téměř konstantní díky výrazným léčebným a diagnostickým pokrokům. Včasná diagnostika onemocnění několikanásobně zvyšuje úspěšnost léčby. S tím souvisí i osvětová činnost a individuální přístup k různým preventivním vyšetřením (mamografie, test na okultní krev ve stolici, kolonoskopie a další), která jsou veřejnosti nabízena.
Rozvíjí se také nové léčebné postupy, vznikají nová chemoterapeutika, je využívána kombinovaná terapie a jsou aplikovány nové poznatky o biologii nádorové buňky.
S tím souvisí rovněž hledání nových prognosticko/prediktivních faktorů umožňujících přesnější rozdělení nemocných do rizikových skupin.
K zlepšení výše uvedených přístupů jsou využívány poznatky speciálních oborů, jako je prediktivní onkologie a molekulární patologie.
Prediktivní onkologie je klinicky orientovaný onkologický výzkum využívající metod buněčné a molekulární biologie. Je přínosný při hledání nových léčebných postupů a léčiv směrovaných na klíčové genetické změny umožňující transformaci normální somatické buňky v nádorovou.
Jsou to především
- poruchy buněčného cyklu,
- poruchy v aktivitě/množství receptorů pro růstové faktory,
- exprese protiapoptických faktorů a
- nesmrtelnost nádorových buněk vázaná či nevázaná na expresi telomerázy.
Chromozomální a genetická analýza nádorových buněk je důležitým faktorem pro prognózu a individualizaci léčby. Problémem jsou zvláště solidní nádory, kde jsou cytogenetické znalosti minimální např. ve srovnání s hematologickými malignitami. V praxi se jedná o stanovení ploidity DNA, chemosenzitivity in vitro, cytogenetické a genetické vyšetření atd.
Molekulární patologie se zabývá studiem procesů souvisejících se vznikem a rozvojem chorob, a to na úrovni nukleových kyselin a proteinů, respektive jiných molekul, které jsou jimi regulovány. Využívá technik molekulární biologie a výsledky jsou dávány do kontextu s nálezy dalších biomedicínských oborů. Umožňuje odhalovat počátky nemoci a nahlédnout až na genovou úroveň.
Význam složení tuků v (par)enterální výživě pacientů
Z poznatků o účincích lipidových složek výživy, zejména vysoce nenasycených mastných kyselin (VNMK), pro rozvoj některých typů nádorových onemocnění vyplývá i význam těchto látek pro terapii. VNMK jsou obsaženy nejen ve stravě, ale jsou součástí lipidových emulzí používaných jako součást umělé výživy pacientů (pooperační stavy, kachexie atd.), jak bylo již uvedeno v kapitole 15. Aplikaci těchto látek by měla být věnována náležitá pozornost v souvislosti s diagnózou, léčbou a rozvojem nádorového onemocnění.
Mechanizmy působení chemoterapeutik
Mechanizmy působení různých typů cytostatik jsou stále předmětem výzkumu. Patří knim zejména mechanizmy ovlivnění buněčného cyklu a indukce apoptózy, aktivace či inaktivace specifických onkogenů, nádorově supresorových genů a transkripčních faktorů i souvislost s oxidativním stresem a stresem endoplazmatického retikula (ER), např. po působení platinových komplexů, antracyklinů, bleomycinu, kamptotecinu či alkylačních činidel. Pozornost je věnována rovněž faktorům rozeznávajícím poškození DNA a mechanizmům reparace DNA (obr. 16-14).
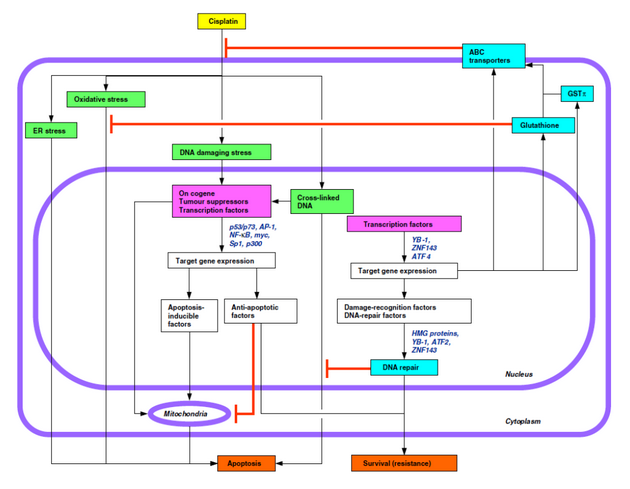
Obr. 16-14 Schéma drah cytotoxického působení cisplatiny a faktory uplatňující se v rezistenci (červeně)
(Kohno K. et al, European Journal of Cancer 2005 : 2577)
Cisplatina a další paltinové deriváty jsou např. zacíleny primárně na DNA jako součást chromatinu a tak způsobují strukturální změny porušující funkční kooperaci nádorových supresorů, nehistonových chromozomálních proteinů, histonů, chromatin remodelujících faktorů, faktorů reparujících DNA a transkripčních faktorů. Ze složek chromatinu rozeznávají cisplatinou modifikovanou DNA histon H1, TATA vazebný protein a HMG (high mobility group) proteiny (obr. 16-15). Působení platinových cytostatik zahrnuje však i další buněčné cíle, které jsou předmětem dalšího výzkumu.
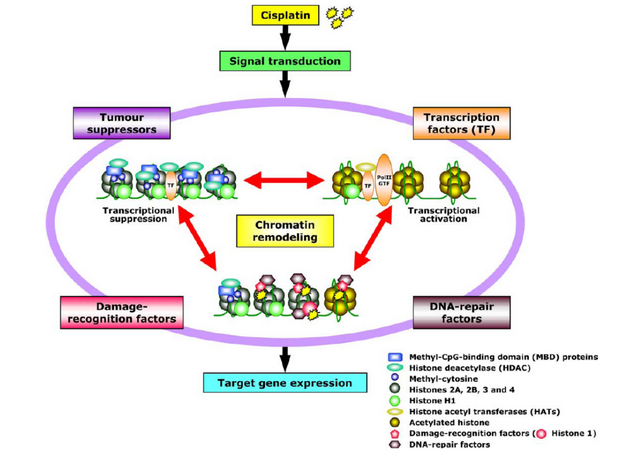
Obr. 16-15 Molekulární interakce spojené s DNA a genovou expresí
Cisplatina aktivuje transkripční faktory, faktory reparace DNA, faktory rozeznávající poškození, nádorové supresory a faktory remodelující chromatin, které interagují a tvoří komplexy, které fungují v jádře. Léky mohou měnit interakční profily. (Kohno K. et al, European Journal of Cancer 2005)
Apoptóza indukovaná chemoterapeutiky může fungovat přes receptory smrti (DR) nebo přes mitochondriální dráhu, mnohdy i kombinovaně (obr. 16-16).
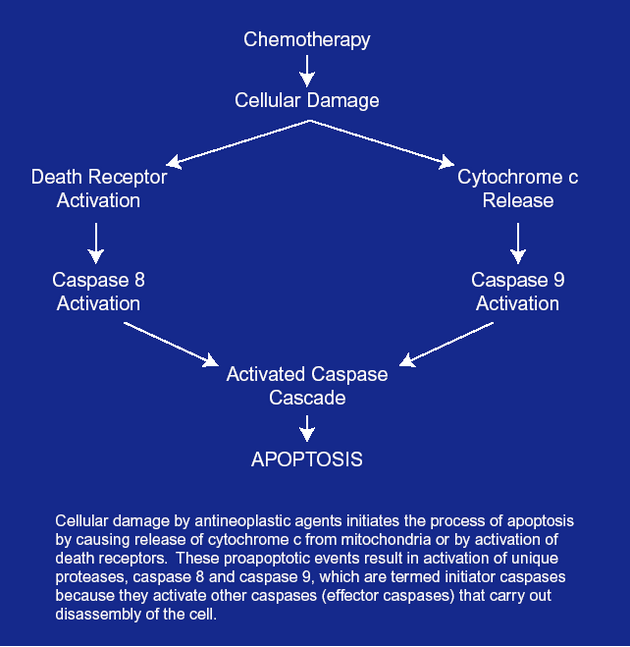
Obr. 16-16 Dvě dráhy aktivace apoptózy chemoterapeutiky
Chemoterapeutika aktivují apoptózu přes mitochondriální dráhu nebo přes aktivaci receptorů smrti („death receptors“)
Stimulace DR specifickými ligandy (DIL) z rodiny TNF jako je Fas ligand (CD95/Fas) nebo TRAIL vybudí agregaci receptoru a připojení adapterové molekuly FADD a kaspázy 8 do komlexu DISC. Aktivní iniciační kaspáza 8 zahajuje apoptózu a štěpí další efektorové kaspázy. Mitochondriální dráha souvisí se změnami na mitochondriích a uvolněním apoptogenních faktorů jako je cytochrom c do cytosolu, kde se vytváří komplex – apoptozóm složený z cytc/Apaf1/kaspáza-9. Protein Smac podporuje aktivaci kaspáz neutralizací inhibičního účinku inhibitorů IAP, zatímco AIF působí kondenzaci DNA. Propojení obou drah se může dít přes protein Bid. Aktivace kaspáz je negativně regulována na úrovni receptorů proteinem FLIP blokujícím aktivaci kaspázy-8 a na úrovni mitochondrií proteiny z rodiny Bcl-2 a IAP. AIF uvolněný z mitochondrií může po translokaci dojádra vyvolávat fragmentaci DNA nezávisle na kaspázách (obr. 16-17).
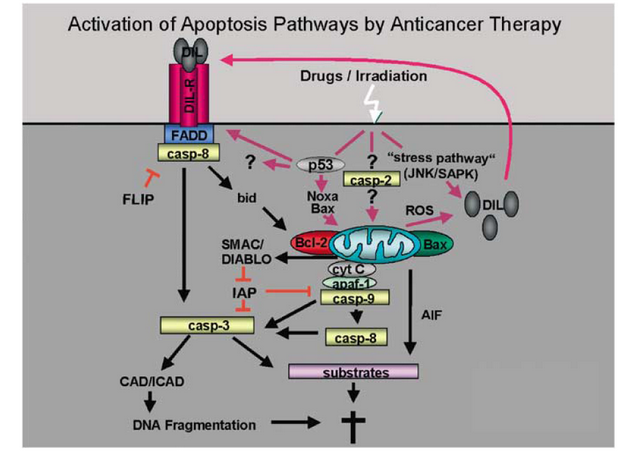
Obr. 16-17 Signální dráhy apoptózy indukované chemoterapeutiky
(Debatin K.M. and Krammer P.H., Oncogene 2004 : 2950)
Expozice buněk velmi nízkými dávkami chemoterapeutik má minimální efekt na viabilitu nebo buněčný cyklus díky dostatečným schopnostem reparačního systému opravit poškození.
Ve vyšších koncentracích v závislosti na přítomnosti nebo nepřítomnosti kontrolního bodu v G1 (souvisejícího s expresí p53) se vyskytují 2 typy odpovědi (obr. 16-18 a 16-19):
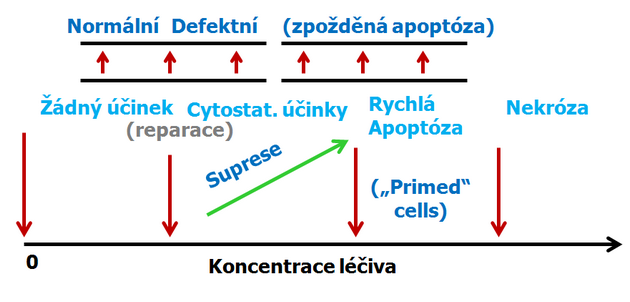
Obr. 16-18 Průchod buněčným cyklem
Obecné schéma účinků vzrůstající koncentrace protinádorových látek poškozujících DNA na buněčný cyklus a apoptózu.
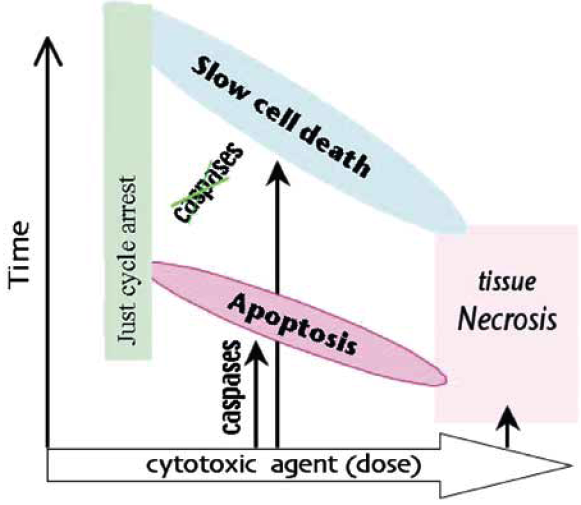
Obr. 16-19 Působení protinádorových terapeutik – závislost typu buněčné smrti na dávce
(Blagosklonny M.V., Oncogene 2004 : 2967)
- v případě funkčního kontrolního bodu je buněčný cyklus zastaven v G1 dokud nedojde k opravě poškození nebo dochází ke spuštění apoptózy při velkém rozsahu poškození (po vysokých koncentracích) nebo neúspěšné reparaci.
- jestliže je kontrolní bod nefunkční (např. při mutaci p53) buňky vstupují do S fáze, ale postup (DNA replikace) je suprimována podle koncentrace látky.
- v případě buněk připravených („primed“) k apoptóze, dojde k apoptóze rychle (3–6 h, „immediate apoptosis“) u prahových hodnot koncentrací, slabě nad těmi, které kompletně inhibují progresi S fáze.
- v případě „non-primed“ buněk vede prodloužená suprese průchodu buněčným cyklem (defective progression) k růstové nerovnováze, sekundárním změnám, následnému nastartování a pozdní apoptóze. Tato apoptóza vykazuje často atypické vlastnosti, komplikované růstovou nerovnováhou a sekundárními změnami metabolizmu.
- při ještě vyšších koncentracích překračujících farmakologickou dávku dochází k nekróze.
Cílem optimální terapie je maximální účinnost na nádorové buňky (zvýšená apoptóza) a zároveň šetrné působení na buňky normální (obr. 16-20).
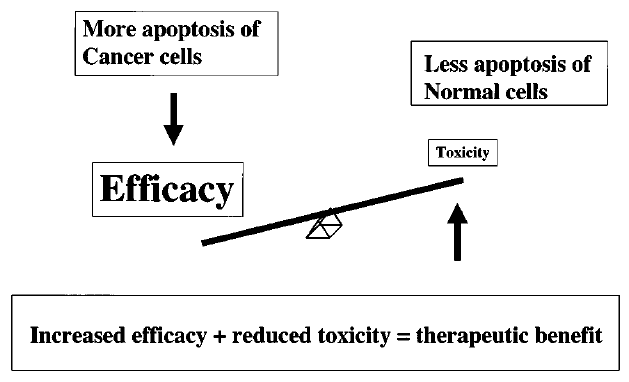
Obr. 16-20 Vhodná strategie pro úspěšnou nádorovou terapii
Nádorové tkáně mají, analogicky jako normální tkáně, proliferující část populace a část populace neproliferující, která se skládá z klidových buněk v G0 fázi nazývané někdy také populace kmenových neoplastických buněk (cancer stem cells – CSC). Tyto buňky je obtížné zničit, protože jsou rezistentní k cytostatickému působení záření nebo chemoterapeutik. Určitou dobu po ozáření nebo chemickém působení vstupují znovu do cyklu a jsou zdrojem obnovy nádorového růstu. CSC jsou důležité pro snížení rizika nádoru, brzkou detekci, prevenci i terapii. Detekce faktorů sekretovaných iniciovanými SC může pomoci brzké detekci. Indukce apoptózy či diferenciace SC působí preventivně. Selektivní eliminace CSC nebo blokování jejich sebeobnovy, např. inhibicí Hedgehog, Notch či Wnt signálních drah, vede k úspěšnější terapii (obr. 16-21).
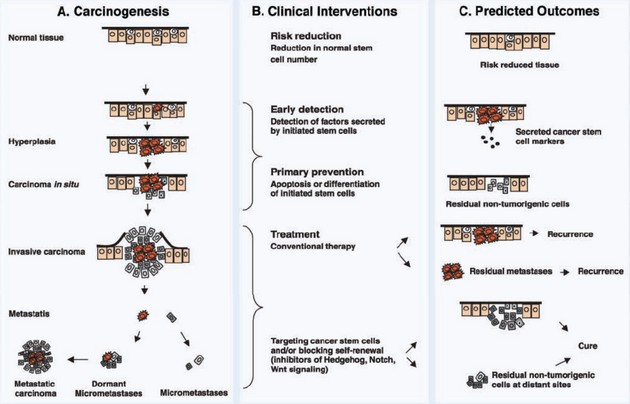
Obr. 16-21 Klinická implikace modelu nádorových kmenových buněk (CSC)
(Wicha M. S. et al., Cancer Research 2006 : 1883)
Opakovaná cytostatická terapie a kombinovaná terapie (s využitím humorálních faktorů, imunologickou indukcí, atd.) představují hlavní přístupy jak dostat do cyklu i klidové buňky, a pak účinně inhibovat jejich růst. Klíčovou otázkou však zůstává volba nejvhodnějšího časového intervalu mezi jednotlivými aplikacemi, k čemuž slouží různé matematické modely. Klidové buňky přežívají mnohem lépe, protože během dlouhého časového intervalu mezi cytostatickým působením a DNA replikací a dělením chromozómů je poškozený genetický materiál reparován.
Rychle rostoucí nádory jsou citlivé na cytostatickou terapii, frakce neproliferujících buněk je malá, buňky mají krátkou generační dobu. Opakovaným působením lze převést klidové buňky ve fázi G0 znovu do cyklu a účinně inhibovat růst (lymfomy, seminomy, některé leukémie).
Pomalu rostoucí nádory mají přechod buněk ze zásobní populace G0 řízen negativní zpětnou vazbou. Tento mechanizmus udržuje vždy minimální hladinu těchto buněk, ze kterých se populace vždy obnovuje. Tyto nádory jsou rezistentní na cytostatickou terapii a je velká pravděpodobnost vzniku rezistentních klonů. Buňky pomalu rostoucích nádorů mají dlouhou generační dobu (karcinom tlustého střeva, žaludku, plic, sarkomy).
Mechanizmy vzniku rezistence k léčivům
Velkou překážkou úspěšné léčby je častý vznik a rozvoj rezistence k léčebným látkám. Ta může vznikat různými mechanizmy (obr. 16-22):
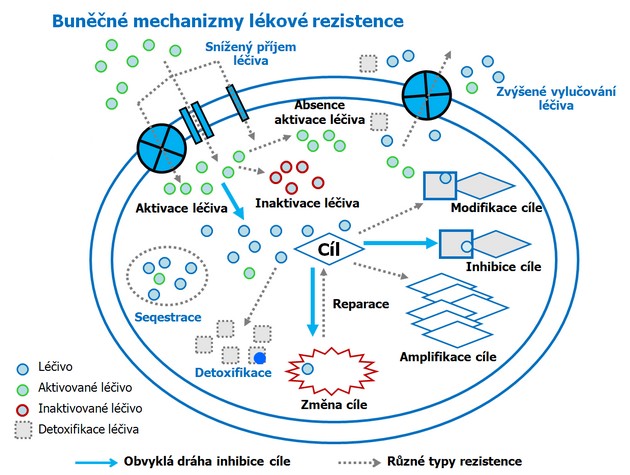
Obr. 16-22 Buněčné mechanizmy lékové rezistence
(podle Saves I. and Masson J.M., Cell Mol Life Sci 1998 : 405)
- snížení vnitrobuněčné koncentrace látky díky změněnému příjmu do nitra buňky, zvýšenému vylučování z buňky nebo rozložení v buňce,
- zvýšená buněčné detoxifikace (inaktivace),
- kvalitativní nebo kvantitativní změny buněčného cíle (enzymu),
- neschopnost přeměňovat látku na aktivní formu,
- zvýšena inaktivace látky,
- zvýšená reparace DNA,
- poruchy v drahách apoptózy.
Mnoho těchto mechanizmů může působit současně a jsou buď přirozeně přítomny v buňce, nebo vznikají de novo během choroby a léčení. Vylučování látky z buňky je spojeno s aktivitou specifických proteinů nebo proteinových komplexů uvnitř cytoplazmatické membrány (obr. 16-23).
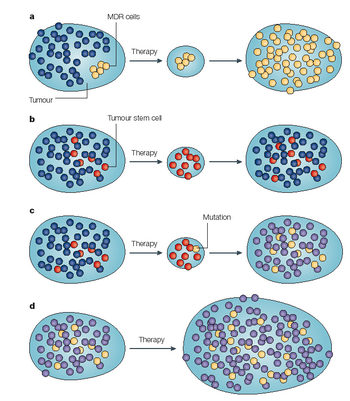
Různé modely lékové rezistence
a)
Genetická změna v nádorové buňce indukuje MDR (multidrug resistance) a vytváří se rezistentní klon.
b)
Malá populace kmenových buněk v nádoru exprimující transportéry léčiva přežívá chemoterapii a repopuluje nádor.
c)
Získaná rezistence – kmenová buňka exprimující transportéry přežívá terapii, kdežto komitované buňky hynou. Mutací pak vzniká v populaci přežívajících kmenových buněk rezistentní fenotyp.
d)
Vnitřní rezistence – jak kmenové buňky tak různě diferencované buňky jsou dědičně rezistentní, takže terapie má malý efekt.
(Dean M. et al., Nature Rev Cancer 2005 : 275)
Předpokládají se dva základní mechanizmy vzniku rezistence k chemoterapii: a) selekce, která zahrnuje tkáňově specifickou expresi genů spojených s lékovou rezistencí a heterogenitu nádorů, b) indukce, kdy protinádorové látky aktivují přenos signálů a transkripčních faktorů podněcujících přechodnou expresi genů lékové rezistence a genů spojených s apoptózou (obr. 16-24). Příklady transkripčních faktorů spojených s lékovou rezistencí jsou uvedeny na (obr. 16-25). Jsou to faktory fungující v rozeznání a reparaci poškození DNA, regulaci buněčné proliferace, nádorvé hypoxii, syntéze glutationu či v angiogenezi.
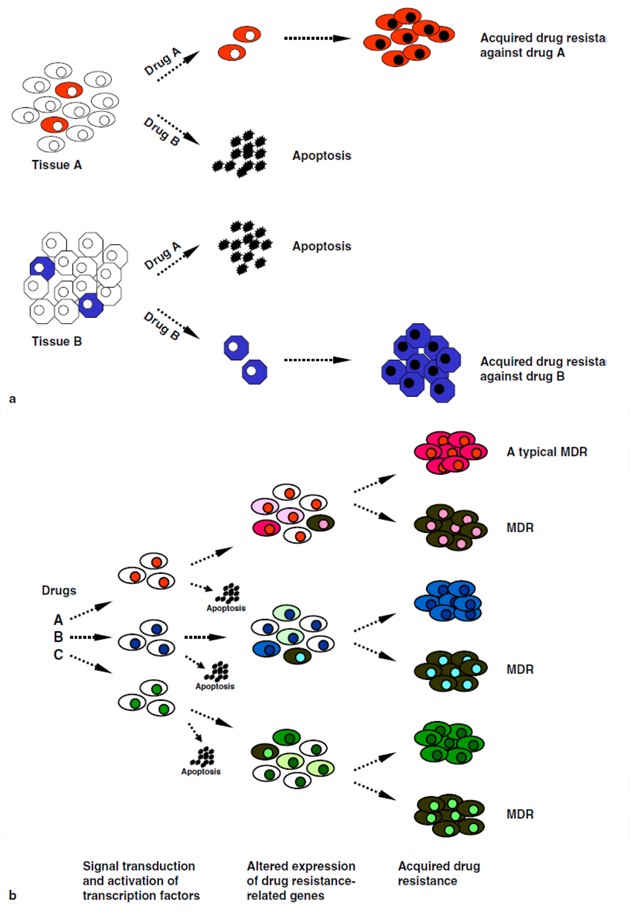
Obr. 16-24 Mechanizmy lékové rezistence: selekce a indukce
(Kohno K. et al. European Journal of Cancer 2005 : 2577)

Obr. 16-25 Příklady transkripčních faktorů spojených s lékovou rezistencí
(Kohno K. et al. European Journal of Cancer 2005 : 2577)
Působení léku v cílovém místě je pak ovlivňováno řadou dalších dějů a podmínek (obr. 16-26). Multiléková rezistence (MDR – "multidrug resistance") k nádorové chemoterapii je spojena se zvýšenou expresí Pgp (P170) glykoproteinu (membránová adenosin trifosfatáza – ATPáza) se širokou specifitou. Transportuje endogenní substance (toxiny, metabolity, odpad, hormony atd.). Farmakologická funkce spočívá v protekci proti cytotoxickým látkám. Mechanizmus MDR je posledních 20 let intenzívně studován. Byl izolován lidský gen MDR1 na chromosomu 7. Tento gen kóduje Pgp a jeho exprese je spojena s MDR fenotypem.
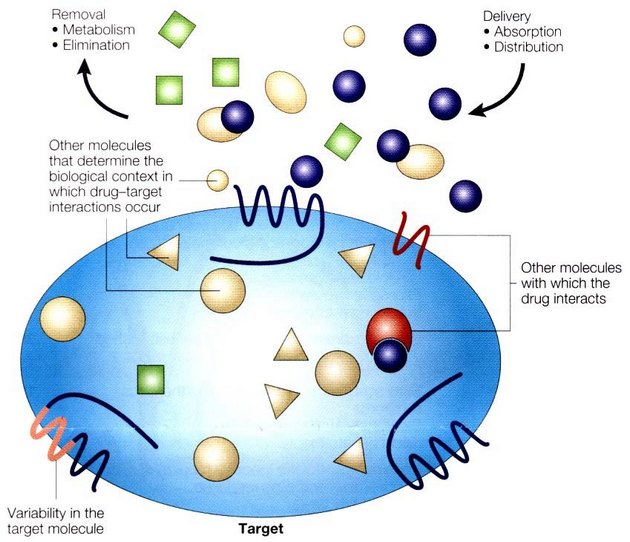
Obr. 16-26 Determinanty působení léku v cílovém místě
(Roden D.M. and George A.L.Jr., Nature Rev Drug Discovery 2001 : 37)
Buněčná detoxifikace. Základní roli v rezistenci nádorových buněk k různým cytotoxickým látkám hraje glutation (GSH), což je vnitrobuněčný tripeptid obsahující cystein a přítomný v savčích buňkách ve vysokých koncentracích. Zvýšená konjugace s GSH je hlavním mechanizmem vývoje rezistence. Hlavní skupinou detoxifikačních enzymů jsou glutation-S-tranferázy (GST) zastoupené čtyřmi známými izoenzymy. Protože katalyzují konjugaci s GSH, je hladina jejich exprese hlavním faktorem určujícím senzitivitu buněk. GSH i GST mohou způsobovat rezistenci i jinými mechanizmy než konjugací, např. GSH může modulovat reparační funkce DNA a tak kontrolovat rezistenci např. k cisplatině. Pro léčebné účely se využívá inhibitorů GSH (indometacin, piriprost).
Rezistence k chemoterapii zprostředkovaná změnami buněčného cíle. Patří sem např. změny topoizomerázy II, která je zásadní pro replikaci DNA a která je cílem interkalačních látek jako je adriamycin, actinomycin D nebo neinterkalačních látek jako jsou etoposid nebo teniposid. Rezistence může být způsobena změnou hladiny topoizomerázy II nebo expresí mutovaného enzymu.
Zvýšená hladina enzymu dihydrofolátreduktázy (DHFR) je příčinou rezistence k antifolátovým látkám jako je metotrexát.
Změny tymidilát syntázy (TS), která je cílem působení 5-fluorouracilu, mohou způsobit dva mechanizmy rezistence: změny afinity TS k lékům díky substituci jedné aminokyseliny nebo zvýšená aktivita TS.
Důležitým mechanizmem rezistence může být rovněž zvýšení reparační funkce DNA. DNA je cílem různých cytotoxických látek. Přímou nebo nepřímou vazbou k DNA způsobují tyto látky změny v DNA a genomové poruchy vedoucí k buněčné smrti.
Jednoduchá alkylační činidla se kovalentně váží k DNA a tvoří vnitro- i meziřetězcové vazby. Deriváty kovů jako je cisplatina tvoří také podobné vazby. Cisplatina obecně porušuje DNA indukcí vnitrořetězcových vazeb mezi N7 atomy dvou sousedních guaninů a v menší míře indukcí meziřetězcových vazeb a monoaduktů. Další cytotoxické látky jsou schopny nekovalentně se vmezeřovat do DNA. Ačkoliv všechny tyto interakce s DNA jsou potenciálně letální, rozsah buněčné smrti je ovlivňován rozdíly v rozsahu reparace. Existuje inverzní vztah mezi buněčnou reparací a cytotoxickou senzitivitou.
Reparační procesy DNA jsou velmi komplexní a závisí na typu poškození. Jejich regulace se účastní na 200 různých genů. Mají velký význam pro nádorovou chemoterapii, protože jsou zahrnuty v rezistenci k velkému počtu cytotoxických látek, zejména těch, které nejsou ovlivněny MDR fenotypem.
Jsou rozeznávány tři hlavní typy reparace DNA:
Reverze poškození je nejjednodušší biochemický pochod obnovující integritu DNA. O6 – alkylguanin DNA alkyltransferáza přispívá hlavním dílem k rezistenci k alkylačním činidlům. Inhibice enzymu významně zesiluje cytotoxické účinky látek. Bohužel, tento zásah může na druhé straně indukovat nádory, protože tento enzym zabraňuje karcinogenním účinkům řady molekul.
Excise pošlození specifickými glykosylázami následuje po specifickém poškození bazí s následným vyříznutím DNA a doplněním pomocí polymeráz a ligáz. Exprese těchto enzymů je u rezistentních buněk pozitivně regulována.
Postreplikační reparace umožňuje nápravu vážných poškození DNA. Jestliže nejsou před replikací opraveny, způsobují tato poškození replikační blok. Buňky obnovují syntézu DNA v jiném replikačním bodě.
Využití inhibitorů reparace DNA může zlepšit terapii. Patří sem inhibice specifických enzymů jako je DNA polymeráza nebo topoizomeráza II.
K úspěšnosti chemoterapie přispívá řada faktorů. Mezi ně patří také farmakologické faktory, které zabraňují adekvátní expozici látkou v místě působení. Zde rozhoduje způsob podávání léku (koncentrace a doba) a dále morfologické podmínky (absorpce, metabolizmus, vaskularita a okysličování tkáně), které ovlivňují biodostupnost léčiva (obr. 16-27). V současné době se rozvíjejí specifické metody dodání léků do cílového místa, jako jsou např. liposomy. Toho lze využít i v případě tzv. genové terapie (obr. 16-28).
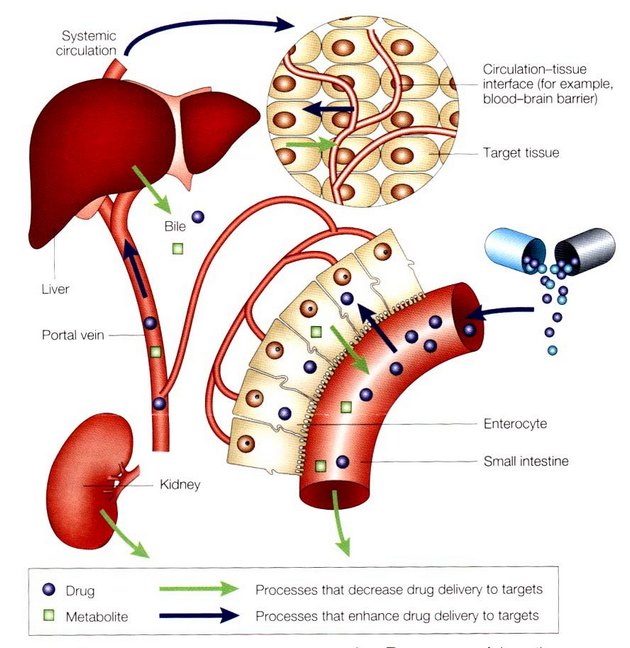
Obr. 16-27 Determinanty dodání léku do cílového místa
(Roden D.M. and George A.L.Jr., Nature Rev Drug Discovery 2001 : 37)
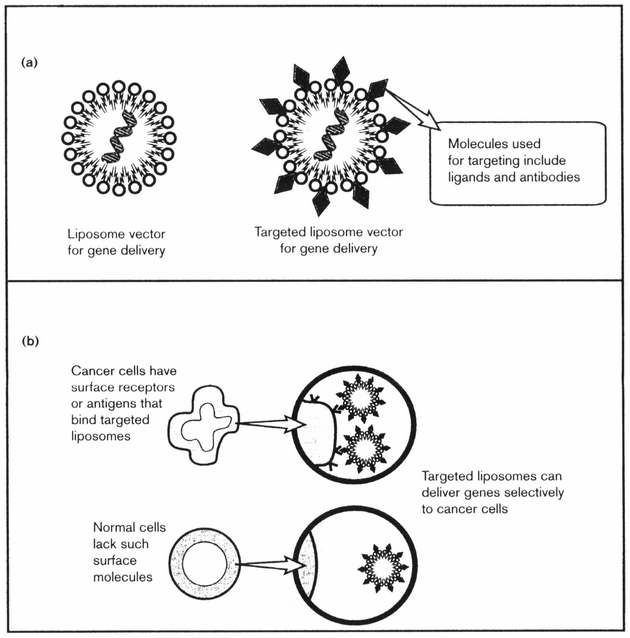
Obr. 16-28 Liposomy a genová terapie
Liposomy jsou využívány v genové terapii (a) a k cílenému dodání látky k nádorovým buňkám majícím příslušné povrchové receptory či antigeny (b).
Kromě těchto faktorů, které mohou být ovlivněny přizpůsobením režimu, existují různé buněčné mechanizmy odpovědné za nízkou či vysokou hladinu rezistence. Na rezistenci se mohou významně podílet poruchy indukce buněčné smrti apoptózou (blok apoptózy). Na základě výzkumu detailních mechanizmů řízení apoptózy lze pak využít látky cílené na její odblokování na různých úrovních signálů (posílení proapotických molekul a inhibice antiapoptických molekul), což může vést k posílení účinků daného cytostatika (obr. 16-29). Inhibice klíčových signálních drah je dalším moderním terapeutickým přístupem. K takovým látkám patří např. inhibitory specifických kináz, které zároveň zastavují buněčný cyklus a tak mohou chránit normální buňky (obr. 16-30).
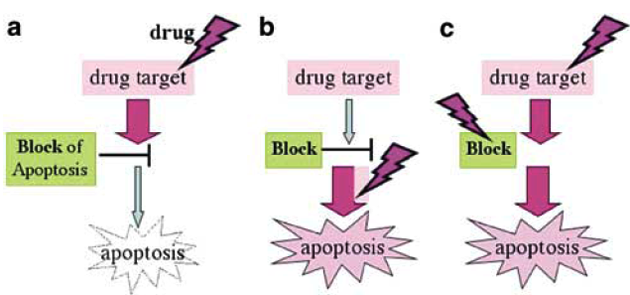
Obr. 16-29 Bloky v indukci apoptózy jsou jedním z cílů překonání lékové rezistence
(Blagosklonny M.V., Oncogene 2004 : 2967)
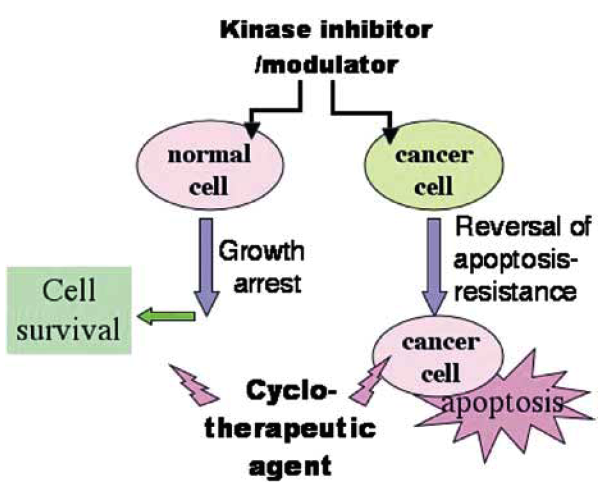
Obr. 16-30 Cykloterapie
Normální buňky podléhají apoptóze, kdežto nádorové buňky bývají k apoptóze rezistentní. Modulací pomocí inhibitorů kináz se stává nádorová buňka k apoptóze citlivá. Zároveň je normální buňka zastavena v buněčném cyklu a chráněna před účinky léčiva.
(Blagosklonny M.V., Oncogene 2004 : 2967)
Jedním z takových cílů je skupina kináz PI3K (phosphoinositide 3 – kinases), které regulují buněčnou odpověď zahrnující mitogenní signály, přežívání a růst, metabolickou kontrolu, cytoskeletální přestavby a migraci. S těmito procesy je spojuje řada dalších molekul, např. kináza Akt (PKB). Ta aktivuje nebo inhibuje řadu molekul uplatňujících se v regulaci transkripce, buněčného cyklu či apoptózy (obr. 16-31).
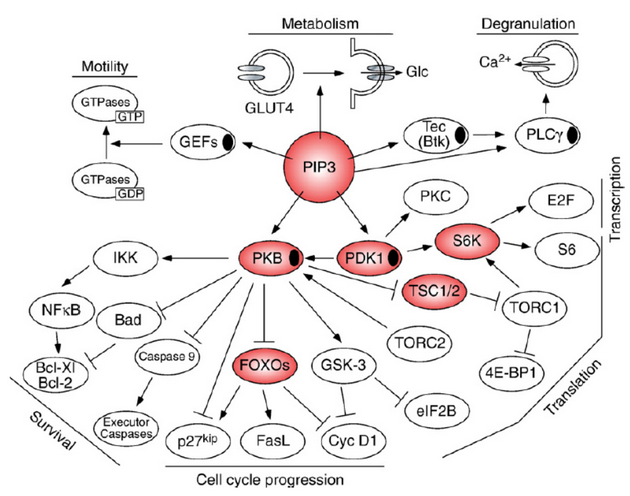
Obr. 16-31 Centrální úloha dráhy PI3K v buněčném růstu, proliferaci, přežívání a motilitě.
(Marone R. et al. Biochimica et Biophysica Acta 2008 : 159)
Další molekulou je mTOR (mammalian target of rapamycin). Aktivace dráhy PI3K/Akt/mTOR zahrnuje ztrátu funkce nádorově supresorového genu PTEN, amplifikaci nebo mutaci PI3K a Akt, aktivaci receptorů pro růstové faktory a expozici karcinogeny. mTOR je klíčovým regulátorem translace proteinů. Pozornost je tedy soustředěna na přírodní a syntetické inhibitory této dráhy, kterých existuje v současné době již velké množství. Jsou využívány zejména kombinace různých látek inhibujících proximální část (inhibitory receptorů pro růstové faktory a onkogenů) s distální inhibicí Akt nebo mTOR. Další přístup je duální inhibice paralelních signálních drah zabraňující aktivaci redundantních drah přežití. Inhibice této dráhy může být také kombinována s jinými typy cílů včetně inhibitorů histon deacetylázových komplexů, proteazomu nebo cyklooxygenázy 2 (obr. 16-32).
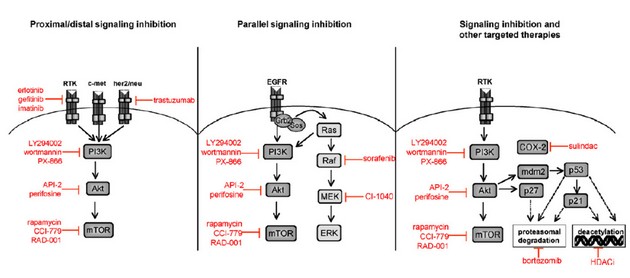
Obr. 16-32 Kombinované přístupy využívající inhibitory dráhy PI3K/Akt/mTOR.
(LoPiccolo J. et al. Drug Resistance Updates 2008 : 32)
Další drahou často deregulovanou u nádorů je Ras/Raf/MEK/ERK mitogeny aktivovaná protein kinázová dráha (MAPK). Zprostředkovává buněčnou odpověď na různé růstové signály. Časté jsou mutace B-Raf vedoucí ke konstitutivní aktivaci MAPK při absenci růstového signálu. Velké úsilí je věnováno hledání specifických inhibitorů komponent této dráhy (obr. 16-33).
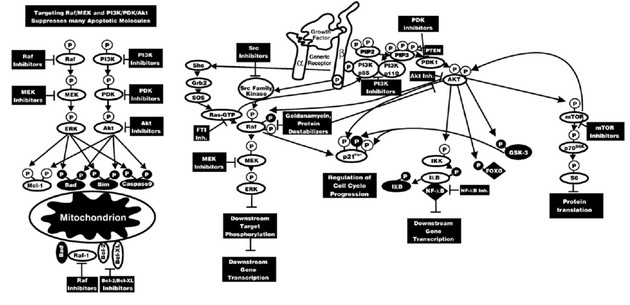
Obr. 16-33 Místa působení nízkomolekulárních inhibitorů signálních drah.
Zásahy do signálních drah Raf/MEK/ERK a PI3K/Akt mohou mít dramatické účinky na řadu molekul regulujících růst a apoptózu (McCubrey J. A. et al., Biochimica et Biophysica Acta 2007 : 1273)
Úloha p53 v predikci odpovědi k chemoterapii
p53 je 53-kD jaderný fosfoprotein, který funguje jako transkripční faktor. Je to produkt 20-kb genu lokalizovaného na krátkém rameni lidského chromosomu 17 a funguje jako nádorově supresorový gen.
Hlavní fyziologické funkce jsou:
- regulace buněčného cyklu v kontrolních bodech G1/S a G2/M
- indukce apoptózy
- stabilizace genomu
p53 kontroluje odpověď buněk na genotoxický stres indukovaný různými podněty. Ovlivňuje růst a viabilitu přes transkripční aktivaci nebo represi řady genů jako jsou p21 (zástava růstu), gadd-45 (reparace DNA), bax, bcl-2, bcl-x, cd95 (apoptóza), mdm2 (zpětnovazebná regulace aktivity p53). Asi 60 % nádorů obsahuje mutovaný typ p53, což způsobuje jeho zvýšenou stabilitu nebo ztrátu aktivity (obr. 16-34).
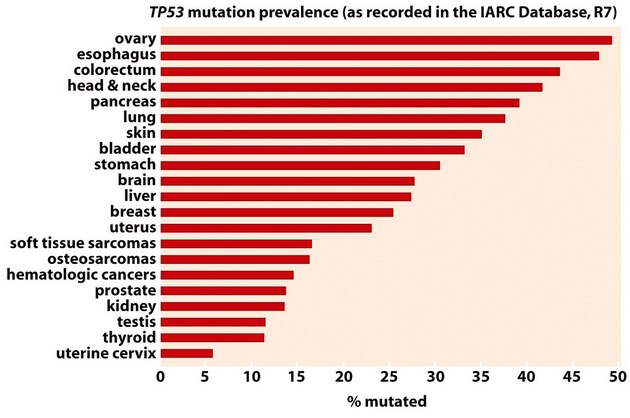
Obr. 16-34 Frekvence mutovaného p53 u různých typů nádorů.
(Figure 9.4, Weinberg R. A., The Biology of Cancer (© Garland Science 2007))
Ztráta aktivity divokého typu (wild-type) p53 je hlavním prediktorem absence odpovědi na radioterapii a chemoterapii u různých typů nádorů (obr. 16-35).
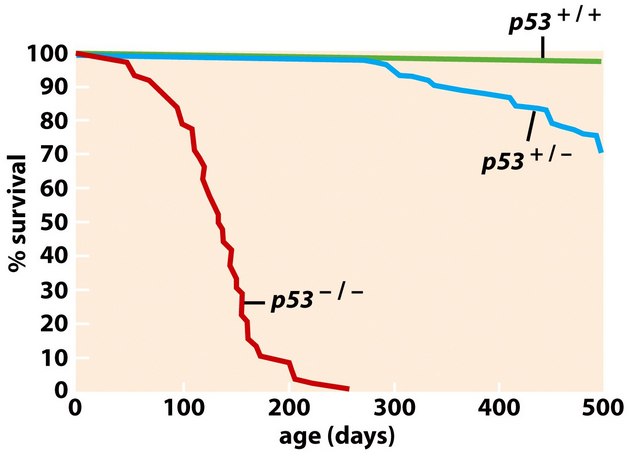
Obr. 16-35 Přežívání u nádorů s různým statusem p53.
(Figure 9.5, Weinberg R. A., The Biology of Cancer (© Garland Science 2007))
p53 zvyšuje chemosenzitivitu podporou apoptózy na transkripci nezávislými nebo závislými mechanizmy (obr. 16-36).
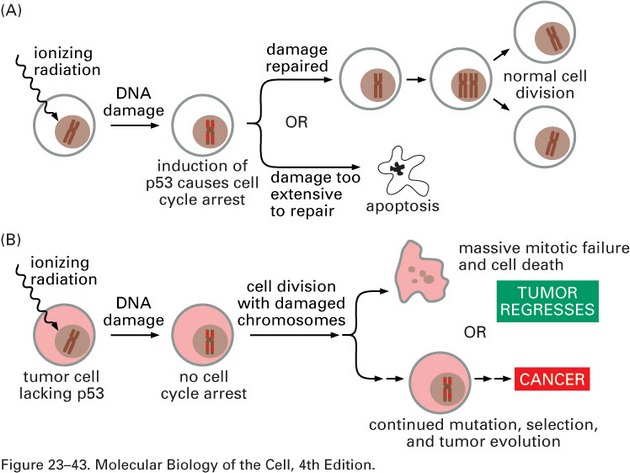
Obr. 16-36 Účinky ionizujícího záření na normální (A) a nádorové buňky (B).
(Figure 23-43. Molecular Biology of the Cell, 4th Edition.)
Aktivuje transkripci proapotických genů jako je bax nebo suprimuje transkripci antiapoptických genů jako je bcl-2. Indukce smrti přes ligandový systém povrchového receptoru CD95(Fas) a Fas ligandu či dalších induktorů buněčné smrti (TNF, TRAIL) může také zahrnovat cesty kontrolované p53 (obr. 16-37).

Obr. 16-37 Cílové geny působení p53 a jejich funkce.
(Table 9.2, Weinberg R. A., The Biology of Cancer (© Garland Science 2007))
p53 může snižovat chemosenzitivitu podporou
- zástavy růstu závislou nebo nezávislou na p21,
- reparace DNA a diferenciace,
- zvyšováním transkripce antiapoptických genů jako je bcl-xL.
Ukazuje se, že účinky změněného statusu p53 na chemosenzitivitu závisejí na buněčném kontextu. Porucha funkce p53 u normálních buněk může spíše zvyšovat než snižovat chemosenzitivitu. Transformované buňky, které mají wild-type p53 mají tendenci stát se rezistentními.
Jedním z budoucích způsobů terapie specificky cílené na buňky s abnormálním p53 by mohl být např. geneticky modifikovaný virus, který by se množil a tak by ničil jen nádorové buňky s mutovaným p53 (obr. 16-38).
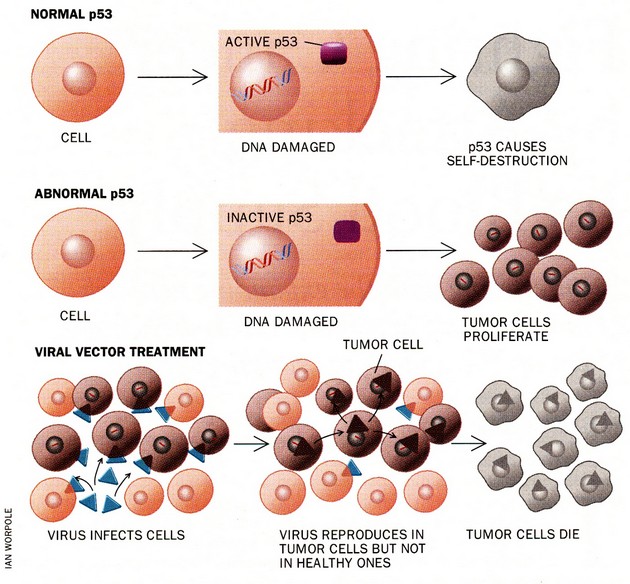
Obr. 16-38 Využití funkce p53 proteinu k selektivní likvidaci nádorových buněk pomocí geneticky modifikovaného viru.
Oliff A. et al., Scientific American 1996 : 144
Prediktivní markery
Pro diagnostické hodnocení i pro vyhodnocování účinků terapie jsou využívány různé prediktivní či prognostické markery.
Proliferační aktivita a nádorový růst
Růst vyjadřuje celkové zvýšení počtu buněk jako výsledek nárůstu buněk s proliferační aktivitou a ztráty buněk apoptózou nebo nekrózou. Proliferační aktivita je výsledkem průchodu buněk buněčným cyklem. Mechanizmus odpovědný za proliferační aktivitu (P) je rychlost buněčného cyklu, která je v inverzním vztahu ke generační době (T) na jedné straně a na druhé straně je ve vztahu k podílu buněk vstupujících do cyklu, tzv. růstová frakce (G).
Matematické vyjádření vztahu je P = G/T
Vysoká proliferační aktivita je tak důsledkem buď velké růstové frakce nebo krátké generační doby nebo obojího.
Čas zdvojení (Td doubling time) nádoru (bez ztráty buněk) je definován jako
Td = T (log 2/log (G+1)
Krátký čas zdvojení je tedy výsledkem buď krátkého buněčného cyklu nebo vysoké růstové frakce nebo obojího.
Proliferační markery
Pro stanovení proliferace buněk byly dříve používány techniky inkorporace značených analogů nukleotidů do DNA jako markerů buněk v S-fázi buněčného cyklu, tj. syntetizujících DNA. Patří sem 3H tymidin (detekovaný autoradiograficky nebo scintilačně) nebo bromdeoxyuridin (BrdU, detekovaný imunohistochemicky či průtokovou cytometrií). Nevýhodou je omezené použití in vivo, radioaktivita, dlouhé časy pro vyhodnocení i subjektivní kriteria.
Nejstarší metodou vyhodnocování proliferace je mitotický index (MI) - mikroskopické počítání mitotických figur na preparátech. Mitózy však představují jen část proliferujících buněk a délka mitózy je variabilní zejména u aneuploidních nádorů. MI jen částečně koreluje s dalšími markery proliferace jako je procento buněk v S-fázi. To je možno stanovit nejlépe pomocí průtokové cytometrie (flow cytometrie), která spočívá ve fluorescenčním barvení DNA vhodnými barvivy (propidium jodid) a měření fluorescence jednotlivých buněk v suspenzi protékající kapilárou před laserovým paprskem. Fluorescenční signál je zpracován systémem různých zrcadel a zesilovačů a výstupem je hodnota v počítači. Z histogramů vyjadřujících obsah DNA (jako hodnotu fluorescence) se vyhodnocují pomocí vhodných počítačových programů procenta buněk v jednotlivých fázích buněčného cyklu.
Dalšími metodami jsou:
Image (static) cytometry spočívá v absorpčním barvení (Feulgenova reakce) a měření buněk na sklíčku.
SPF – S-phase fraction – celkem koreluje s dalšími markery (např. MI nebo Ki67)
Imunohistochemické stanovení antigenů spojených s proliferací jako je PCNA (proliferating cell nuclear antigen), jehož exprese je zvýšena u proliferujících buněk – koreluje s ostatními markery, ale ne vždy. Nepříliš vhodný u nádorů, bývá zvýšený i při reparaci DNA.
Ki67 je protein kódovaný genem na chromozómu 10 a je exprimován v G1, S a G2 fázi u proliferujících buněk. Částečně koreluje s dalšími markery.
DNA topoizomeráza II, jejíž exprese se rychle zvyšuje při přechodu S a G2 fáze a snižuje se na konci mitózy.
Organizátory jadérka (NORs) jsou segmenty DNA spojené s jadérky, které obsahují geny kódující ribozomální DNA. Přispívají k regulaci syntézy proteinů. Jsou vizualizovány barvením stříbrem metodou AgNOR. Koreluje s SPF, Ki67 a MI.
Markery buněčné smrti
Vyhodnocuje se tzv. apoptický index (AI). Metody detekce apoptózy jsou různé, ale k nejběžnějším patří morfologické hodnocení světelnou a zejména fluorescenční mikroskopií a
flow cytometrie (stanovení subdiploidní populace, vazba Annexinu V, barvení fragmentů DNA, tzv. TUNEL, aktivita kaspáz atd.)
Jako další markery mohou sloužit specifické molekuly na buněčném povrchu:
Jako proliferační marker např. CD71 – receptor pro transferin nebo receptory pro specifické růstové faktory (EGF). Jako ukazatel apoptózy exprese receptorů smrti jako je CD95 (Fas).
Významné mohou být i změny cytoskeletonu nebo sledování markerů neproliferujících a klidových buněk jako je statin.
Molekulárně biologickými metodami lze sledovat rovněž změny specifických protoonkogenů a nádorově supresorových genů, např. fosforylace RB proteinu, exprese a status p53 (wild type, mutace), antiapoptické vs. proapotické proteiny (bcl-2, Mcl-1, bak, bax a další).
Pokročilejšími metodami jsou různé typy „microarray“ analýz detekujících změny velkého počtu genů či proteinů zároveň. Při srovnávací genomové hybridizací (CGH) a expresní microarray analýze je základní komponentou fluorescenční poměrná hybridizace (obr. 16-39).
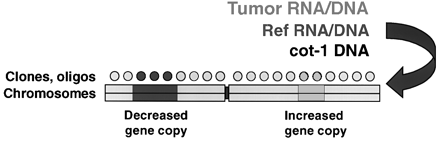
Obr. 16-39 Srovnávací genomová hybridizace a expresní microarray analýza.
Při ní jsou srovnávány dva vzorky nukleových kyselin, které jsou různě obarveny fluorochromy reagujícími v různých vlnových délkách. Ty jsou hybridizovány za přítomnosti nadbytku neznačené DNA reprezentující genom, jehož informace je mapována. U CGH mohou být použity metafázické chromozómy nebo array z klonovaných prob. U expresní microarray analýzy jsou využívány array z klonů cDHA nebo oligonukleotidů. Praktický příklad CGH analýzy je na obrázku 16-40.
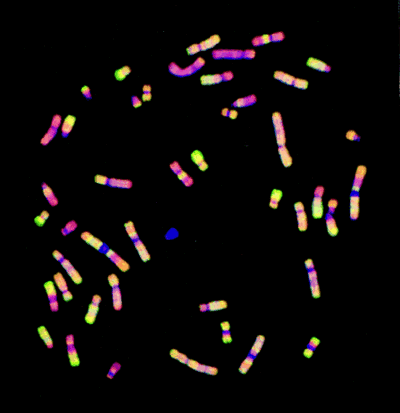
MCF7 DNA byla označena zeleně a normální referenční DNA červeně. Chromozómy byly označeny modře DAPI.
Úseky se slabou hybridizací se pak jeví modře, oblasti se zvýšeným množstvím kopií zeleně a oblasti se sníženým množstvím kopií červeně.
Při hodnocení a využívání jednotlivých přístupů jsou velmi důležité:
- Otázka interpretace a klinické využitelnosti jednotlivých markerů
- Standardizace metod a hodnocení mezi laboratořemi
- Problematika heterogenity nádorů
- Statické vs. dynamické stanovení parametrů, tj. časový rozvoj
- Exprese a změny různých onkogenů, které mohou podmiňovat citlivost nádorových buněk k chemo- a radioterapii
- Postižení vzájemných vztahů jednotlivých markerů
- Predikce odpovědí na léčbu
Pro predikce se využívá také různých biomatematických přístupů jako jsou multivariační analýzy, analýza základních (principal) component a diskriminační analýza.
Nové směry vývoje protinádorové léčby
Zlepšující se znalosti v oblasti biologie a imunologie hostitele a nádorové patofyziologie umožnily využít další nové přístupy v terapii nádorových pacientů. Na základě poznatků z výzkumu jsou využívány látky, které mohou přímo a cíleně zasáhnout do klíčových mechanizmů karcinogeneze na buněčné úrovni (targeted therapy). Používá se často v kombinaci s konvenčními léčebnými postupy. Příkladem je:
- Terapie cílená proti EGF receptoru, kdy se využívá monoklonální protilátka s vazbou na receptor, inhibitory tyrozinkináz, „antisense nukleotidy“, případně vakcína proti receptoru nebo ligandu
- Diferenciační terapie využívaná zejména u hemopoetických malignit, kdy se pomocí specifických látek navozuje diferenciace nezralých buněk (kyselina all-trans retinová, vitamín D3, butyrát)
- Využití inhibitorů přenosu signálů:
- Inhibitory tyrozinových kináz
- Inhibitory cyklin-dependentních kináz – ovlivnění buněčného cyklu
- Inhibitory jiných kináz – např. MAP kinázy, JNK
- Inhibitory farnesyltransferázy, které inhibují onkoprotein ras spojený s vnitřní stranou plazmatické membrány izoprenoidní lipidovou skupinou – farnesylem. Mutace protoonkogenu ras je častá u nádorů a vede k nekontrolované proliferaci, inhibici apoptózy a zvýšení angiogeneze.
Genová terapie představuje postup mající za cíl napravit genetickou odchylku způsobující vývoj nádorové buňky (p53, geny rezistence, sebevražedné geny, cytokiny). Využívají se tzv. „antisense“ oligonukleotidy, které vyblokují činnost onkogenu.
Antiangiogenní terapie je cílená proti tvorbě nových cév v nádoru a využívá inhibitory proteáz, inhibitory migrace a proliferace endotelu i inhibitory angiogenních růstových faktorů.
Další možností je stimulace obranných mechanizmů hostitele včetně specifických a nespecifických imunologických přístupů a strategie cílené přímo na změnu nádorového růstu a diferenciace terapeutickým ovlivněním patofyziologických mechanizmů.
Imunoterapie je intervence do imunitních mechanizmů hostitele s cílem obnovit nebo modifikovat funkce imunitního systému (substituční, supresivní nebo stimulační, aktivní vs. pasivní, specifická a nespecifická). Buněčná imunoterapie spočívá v podání buněk imunitního systému s protinádorovou aktivitou vedoucí k cílenému zasažení nádorové tkáně a překonání tolerance a imunosuprese vyvolané nádorem.
Terčem pro imunitní reakci mohou být i nádorové antigeny, kterými se nádorové buňky liší od normálních. Nádory však vykazují mnohdy velmi malou specifickou imunogenitu.
Nespecifická buněčná imunoterapie posiluje protinádorovou imunitu nezávisle na specifických nádorových antigenech. Principem je kultivace efektorových buněk ex vivo s látkami, které aktivují nebo posilují jejich protinádorový účinek (lymphokine-activated killer LAK buňky, natural killer NK buňky, aktivované monocyty-makrofágy). Tyto postupy jsou zkoušeny desítky let, ale praktické využití je stále malé.
V současné době se vyvíjejí rovněž tzv. protinádorové vakcíny, které navozují specifickou imunitní odpověď proti nádorovým buňkám v primárním nádoru i metastázách. Využívají se k tomu dendritické buňky (obr. 16-10).
Terapeutické aspekty využití cytokinů
Biologická terapie s využitím cytokinů a růstových faktorů představuje zcela nový přístup. Hemopoéza může být ovlivňována buď hemopoetickými růstovými faktory (kolonie stimulující faktory, interleukiny) nebo negativními regulátory, které mohou zabránit poškození kmenové buňky během chemoterapie. Na základě poznatků o autokrinních mechanizmech růstu mohou být klidové maligní buňky uvedeny do buněčného cyklu svými růstovými faktory, čímž se stanou citlivější k chemoterapii. Je však nutné si uvědomit, že vědomosti o biologické terapii jsou teprve na počátku, zvláště pokud se týče všech aspektů fascinující propojené sítě cytokinů. Proto je nutná blízká spolupráce mezi preklinickými a klinickými badateli.
Cytokiny a růstové faktory přenášejí signály mezi hemopoetickým a imunitním systémem buď samotné, nebo indukcí uvolňování dalších cytokinů. Je nutné si uvědomit, že ovlivňování pacientů cytokiny podléhá zcela jiným pravidlům, nežli působení cytotoxickými látkami. Cytokiny mají široké spektrum účinků in vivo jako je modulace imunitní odpovědi, stimulace hemopoézy, přímá regulace buněčného růstu a diferenciace, toxicita pro nádorové buňky, účinky na vaskularizaci nádorů apod. Navíc nevykazují jen primární účinky, ale spouštějí kaskádu sekundárních účinků.
Některé z těchto faktorů jsou běžně používány, ale potenciální klinické využití není úplně objasněno. Využívají se faktory uplatňující se v pozitivní i negativní regulaci, v autokrinním růstu a imunomodulační látky. Podpora hemopoézy je nutná nejen u hemopoetických malignit, ale také při ozařování a chemoterapii jiných nádorů, kdy dochází k poškození krvetvorby. V mnoha klinických studiích aplikace G- a GM-CSF zabraňuje nebo redukuje neutropenii po chemoterapii a zvyšuje počty neutrofilů u primárních poruch kostní dřeně.
IL-3 nazývaný multi-CSF podporuje přežívání in vitro, proliferaci a vývoj multipotentních hemopoetických kmenových buněk a komitovaných progenitorů pro granulocyty a makrofágy, erytrocyty, megakaryocyty, eosinofily a basofily. Jedním z hlavních důvodů aplikace hemopoetických růstových faktorů je skutečnost, že použití cytotoxických látek je striktně limitováno dávkou. Vysoké dávky chemoterapeutik jsou s ohledem na nádor vysoce účinné, ale dochází po nich k silné myelosupresi umožňující rozvoj infekcí a sepse. GM- a G-CSF umožňují zvýšení jednorázové dávky chemoterapeutik nebo redukci intervalu mezi jednotlivými aplikacemi. Také IL-3 významně zvyšuje zotavení leukocytů, neutrofilů a destiček. Růstové faktory se také využívají pro zvýšení množství progenitorů v krvi při autologní transplantaci buněk periferní krve (při chemopterapii) a pro zlepšení podmínek po transplantaci kostní dřeně.
Hodnocení dat – vícerozměrné analýzy
Průnik metod molekulární biologie do onkologické diagnostiky vyžaduje zpracování multiparametrických (vícerozměrných) souborů dat. Jedná se o data např. z „array“ analýz (DNA, proteiny), lipidomická data a další.
K tomu jsou využívány pokročilé biomatematické a bioinformatické přístupy. Multivariační analýzy (analýza základních komponent a diskriminační analýza) jsou využívány pro predikce onemocnění (obr. 16-41).
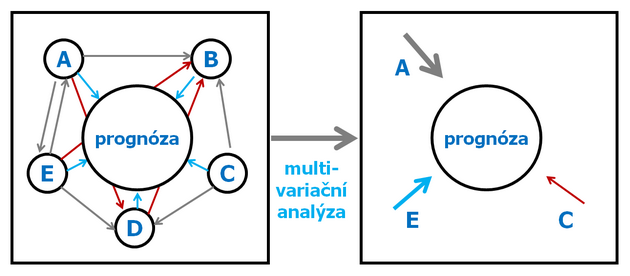
Obr. 16-41 Vyhodnocení biomarkerů pro predikci onemocnění.
podle Hermanet P., J Clin Epidemiol 1999 : 371
Důležitými výstupy jsou stanovené biomarkery, případně tzv. „surrogate biomarkers“ – „náhradní“ biomarkery, které jsou využívány při stanovení diagnózy, predikce a průběhu léčby onemocnění.
Patří mezi ně:
- důležité genetické a cytogenetické markery,
- exprese významných regulačních genů,
- aktivity specifických enzymů,
- cytokinetické parametry,
- parametry angiogeneze, atd.
Provádí se rovněž vyšetření na chemorezistenci v testech in vitro (MTT test) a související znaky jako je exprese proteinů souvisejících s rezistencí (MRP, PGP).
Tato data doplňují standardní klinická vyšetření a nespecifické ukazatele imunologického a fyziologického stavu pacienta.
Je nutné vytvořit systém hodnocení takovýchto dat s cílem určit jejich prognostický význam a zajistit zpětnou vazbu lékaře k těmto hodnoceným datům. To směřuje k individualizaci léčby, která může přinést výrazný prospěch pro pacienta (obr. 16-42).
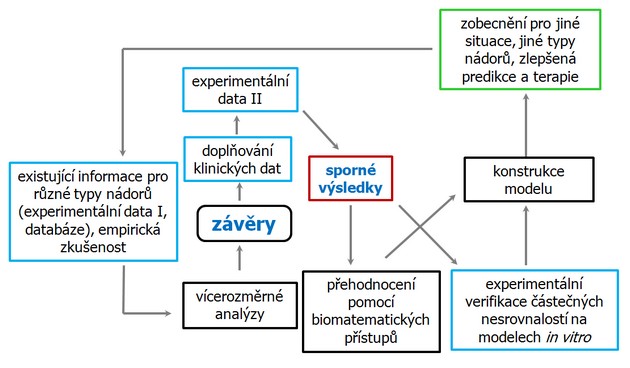
Obr. 16-42 Vzájemný vztah experimentálních dat, klinických dat a jejich biomatematického vyhodnocování směřující k zlepšení predikce a terapie nádorových onemocnění.
Kontrolní otázky k tématu
Proč je důležitá prevence onemocnění?
Jak lze charakterizovat primární, sekundární prevenci a terapii?
K čemu je užitečné sestavování tzv. „family trees“? Jste schopni sestavit alespoň částečné takové schéma ve vaší rodině?
Co je to chemoprevence? Vyjmenujte některé chemopreventivní látky.
K čemu slouží nádorové markery a jakého mohou být charakteru? Uveďte některé příklady.
Jaký je rozdíl mezi buněčnými a genetickými nádorovými markery? Uveďte příklady.
Jaké metody se využívají k diagnostice nádorového onemocnění a k detekci jeho markerů?
Podle čeho jsou nádorová onemocnění klasifikována?
Jaké základní léčebné metody jsou využívány u nádorových onemocnění?
Jaké jsou nejvyužívanější typy chemoterapeutik?
Čím je charakterizována biologická terapie?
K čemu slouží podpůrná a paliativní léčba?
Kdy se využívá metody autotransplantace krevních buněk?
Jaké jsou představy o budoucím využití transplantace kmenových buněk?
Jaké jsou výhody individualizované léčby?
Čím se zabývají obory prediktivní onkologie a molekulární patologie a jaké přístupy využívají?
Kde jsou v klinice běžně využívány lipidy?
Jakými základními mechanizmy působí cytostatika a jak jsou jejich účinky závislé na použité koncentraci?
Jaký význam mají tzv. nádorové kmenové buňky?
Jaké výhody má využití kombinované terapie?
Který typ nádoru reaguje lépe na terapii – rychle či pomalu rostoucí?
Které mechanizmy v sobě může zahrnovat rezistence k léčebné látce?
Co znamená pojem multiléková rezistence?
Které důležité faktory se účastní buněčné detoxifikace?
Jak mohou být účinky léků ovlivněny reparačními schopnostmi DNA?
Jaký je význam p53 v odpovědi na chemoterapii?
Charakterizujte využívané prediktivní nebo prognostické markery.
Jaké další terapeutické přístupy jsou využívány na základě nových vědeckých poznatků?
Jak je využívána tzv. imunoterapie?
Jak mohou být v léčbě nádorů využity cytokiny?
Jaké přístupy jsou využívány pro hodnocení onkologických dat?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041