Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Hormonální karcinogeneze
Endogenní faktory
V současné době se ukazuje velký podíl faktorů prostředí na vzniku lidské neoplasie. Největší podíl připadá na potravu a kouření, ale významnou roli hrají též infekční látky, expozice průmyslovými látkami a zářením. S výjimkou kouření jako přímé příčiny vývoje plicního karcinomu a karcinomu močového měchýře není přesný mechanizmus a podíl dalších faktorů úplně jasný.
Kromě toho musíme brát v potaz i endogenní faktory. Řada chemických sloučenin produkovaných v organizmu může být karcinogenních (např. produkty oxidativního metabolizmu). Bez výjimky jsou klasifikovány jako promoční na základě jejich funkce v regulaci genové exprese. Jejich působení na buněčnou replikaci a genovou expresi je reverzibilní, což zajišťuje maximální pružnost při udržování homeostázy v organizmu.
Je také prokázáno, že endogenní pohlavní steroidy a řada žlučových kyselin produkovaných v gastrointestinálním traktu hraje důležitou roli v lidské karcinogenezi. Vysoké dávky estrogenů aplikované zvířatům vyúsťují v rakovinu ledvin. Endogenní prolaktin je významným faktorem vývoje neoplasie u řady živočišných druhů, ale u člověka tato spojitost zcela prokázána nebyla. Účinnějšími karcinogeny jsou syntetické estrogeny i androgeny (hepatokarcinogeneze). Také řada endogenních polypeptidů vykazuje karcinogenní účinky v různých systémech.
Mechanizmy endogenních faktorů
Neoplasie hormonálně závislých tkání představuje víc než 32 % nově diagnostikovaných nádorů u mužů a více než 40 % u žen. Estrogeny a v menší míře androgeny jsou základní steroidní hormony, které mohou být karcinogenní in vivo (obr. 9-1). Na molekulární úrovni jsou jejich účinky na genovou expresi zprostředkovány jejich specifickou interakcí s endogenními receptorovými proteiny produkovanými cílovou buňkou (obr. 9-2). Komplex steroid-receptor interaguje se specifickými sekvencemi regulačních oblastí řady genů, čímž mění jejich transkripci. Jeden nebo více těchto genů je pravděpodobně důležitých v obecném mechanizmu nádorové promoce zmíněnými metabolity. K takovým genům patří i ty, jejichž proteinové produkty jsou součástí mezibuněčných gap junctions. Inhibice GJIC je spojena s mechanizmem nádorové promoce. Některé žlučové kyseliny inhibují GJIC v systémech in vitro. Avšak syntetické estrogeny nevykazují inhibici GJIC v buněčných kulturách. Naproti tomu polypeptidické hormony působily inhibici.
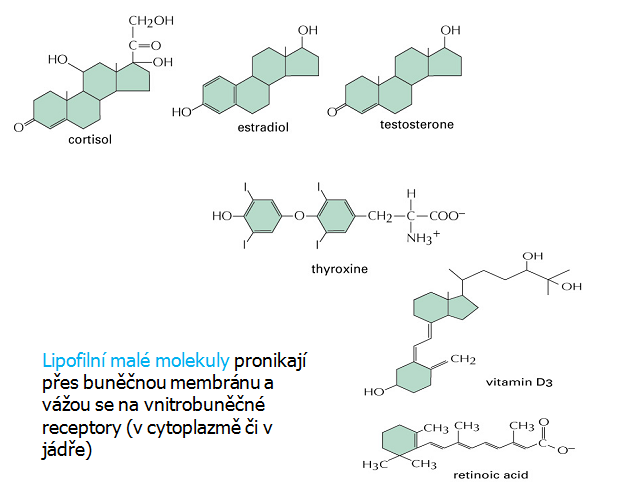
Obr. 9-1 Struktura hormonů vybuzujících signál vazbou na vnitrobuněčné receptory
(Figure 15-12. Molecular Biology of the Cell, 4th Edition)
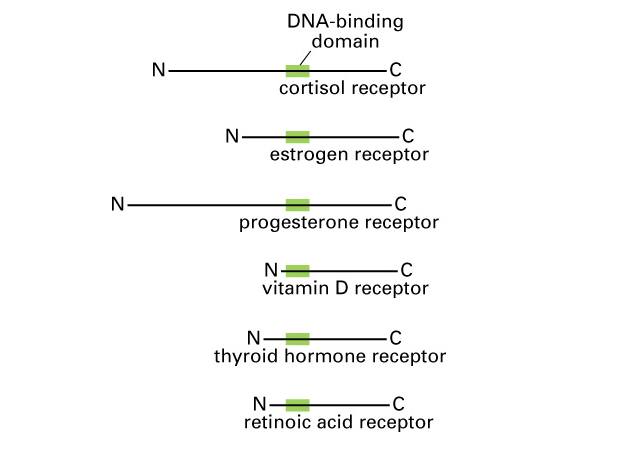
Obr. 9-2 Podobná struktura receptorů s vazebnou doménou
(Figure 15-13. Molecular Biology of the Cell, 4th Edition)
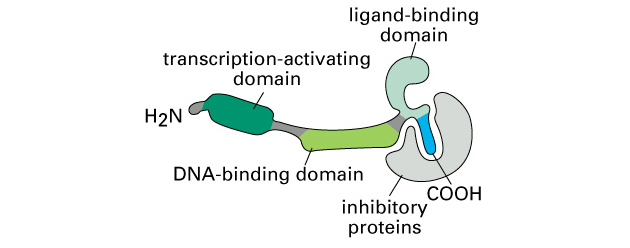
Obr. 9-3a Receptorový protein v inaktivní formě vázán na inhibiční proteiny
(Figure 15-13. Molecular Biology of the Cell, 4th Edition)
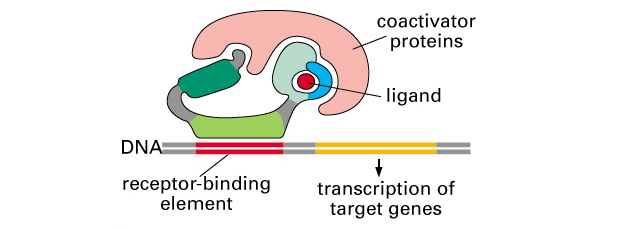
Obr. 9-3b Disociace inhibičního proteinu po vazbě ligandu a navázání koaktivátoru k doméně receptoru aktivující transkripci
(Figure 15-13. Molecular Biology of the Cell, 4th Edition)
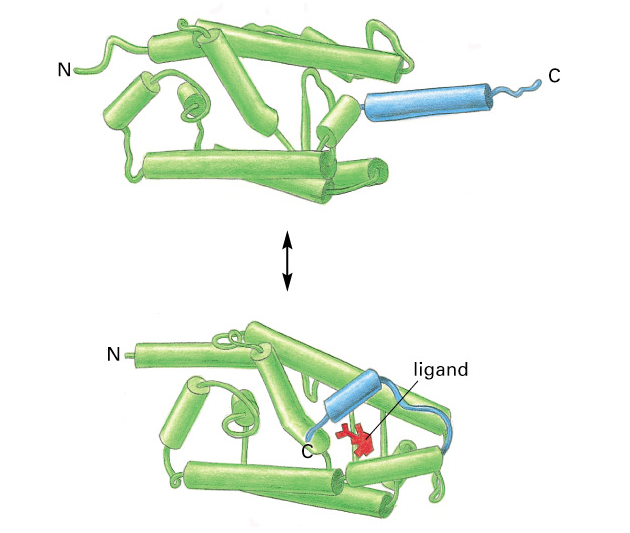
Obr. 9-4 Trojrozměrná struktura domény vážící ligand bez a s navázaným ligandem. Alfa helix (modře) funguje jako víčko zajišťující polohu ligandu
(Figure 15-13. Molecular Biology of the Cell, 4th Edition)
Další gen, jehož změna exprese v odpověď na působení estrogenu může být důležitá v promočním působení, je receptor pro EGF, jehož transkripce významně vzrůstá po působení estrogenu (obr. 9-5).
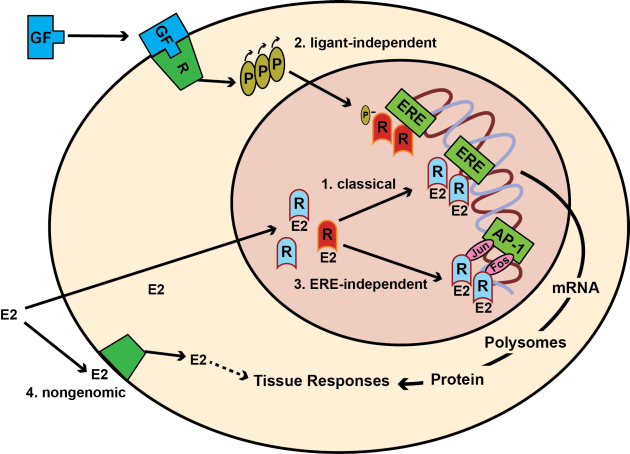
Obr. 9-5 Stimulace estrogenního receptoru
Hlavní účinek promočních látek je zvýšení rychlosti buněčné proliferace v cílové iniciované buněčné populaci. Tento účinek je jasný u specifických polypeptidických hormonů stejně jako u polypeptidových růstových faktorů. Jejich působení na iniciovanou buňku je silnější než na buňku normální.
Ačkoliv stadium nádorové promoce klasicky nezahrnuje změny v DNA, řada studií prokázala, že jisté promoční látky mohou způsobovat tvorbu aktivních kyslíkových radikálů. Tyto radikály pak mohou působit nebo stimulovat peroxidaci nenasycených lipidů a tvorbu dalších radikálů, které mohou působit na makromolekuly jako je DNA. Důkazy nejsou však jednoznačné.
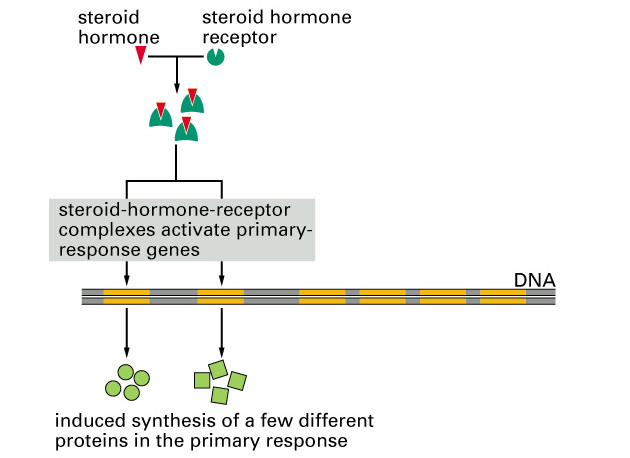
Steroidní hormony jsou již dlouho známy jako důležité regulátory podporující růst určitých typů nádorů a je prokázán jejich vliv na expresi jaderných protoonkogenů. Steroidní hormony (estrogen, testosteron, progesteron, androgen i glukokortikoidy), protože jsou malé a lipofilní difundují přes membránu do buňky, kde se váží na specifický vnitrobuněčný receptor. Aktivovaný komplex se pak váže na specifické sekvence v DNA, tzv. „steroid response elements“ (SRE). Funguje tedy jako transkripční faktor, který moduluje na steroidy odpovídající geny nebo mění postranskripční děje vyúsťující ve změny hladiny specifických mRNA nebo proteinů (obr. 9-6).
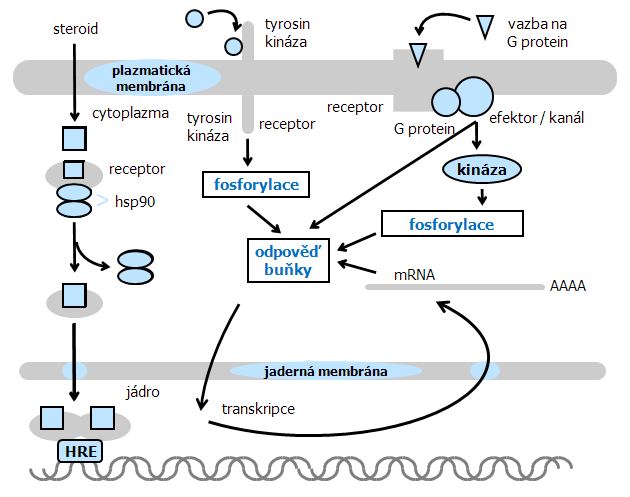
Obr. 9-6 Srovnání působení steroidů přes vnitrobuněčné receptory a přenosu signálu aktivací membránových receptorů
Obr. 9-7a Raná primární odpověď na působení steroidního hormonu
(Figure 15-14. Molecular Biology of the Cell, 4th Edition)
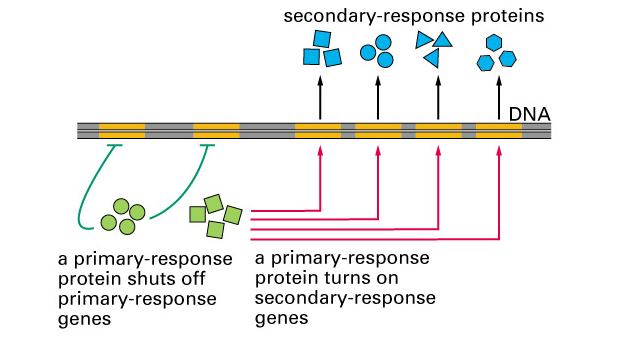
Obr. 9-7b Zpožděná sekundární odpověď na působení steroidního hormonu
(Figure 15-14. Molecular Biology of the Cell, 4th Edition)
Hormonálně závislé nádory (prsu, endometria, prostaty, varlat, štítné žlázy, kostí) představují ojedinělý mechanizmus karcinogeneze. Endogenní a exogenní hormony podporují proliferaci, zvyšují počet buněčných dělení a pravděpodobnost náhodných genetických chyb (obr. 9-8). Hormonální stimulace působí v promočním stadiu a pokračuje do progresivního stadia. Přerušení této dráhy pomocí antihormonální terapie (např. tamoxifen) zpomaluje proces progrese. Byly objeveny specifické geny, jejichž mutace jsou spojeny s hormonálně závislými nádory. Zahrnují geny endokrinní regulace, geny reparace DNA, nádorově supresorové geny a onkogeny. BRCA1 a 2 jsou nádorově supresorové geny spojené s náchylností k nádorům prsu a vaječníků.
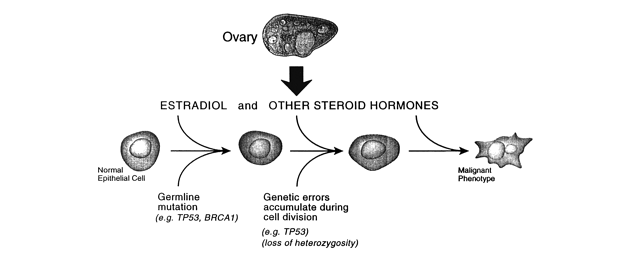
Obr. 9-8 Estradiol a v menší míře ostatní steroidní hormony podporují buněčnou proliferaci, která usnadňuje fixaci genetických chyb. Zárodečné mutace v příslušných nádorově supresorových genech urychlují transformaci do maligního fenotypu.
Následující údaje vycházejí z epidemiologických a experimentálních studií:
Nádory endometria
Expozice estrogeny nevyrovnávaná progestiny je riziková pro vznik nádorů endometria. Během premenopausálního stadia je riziko spojeno s mitotickou aktivitou v první polovině menstruačního cyklu, kdy působí estrogen bez protipůsobení progesteronu. Ukázalo se, že užívání hormonální antikoncepce před r. 1976 zdvojnásobovalo riziko u žen. Naproti tomu novější preparáty kombinující estrogen a vysoké dávky progesteronu (od 21 do 28 dne cyklu) mohou snižovat riziko.
Důležitým rizikovým faktorem je také obezita, která ovlivňuje produkci hormonů. Vyšší riziko existuje u bezdětných žen a snižuje se s každým těhotenstvím. Během těhotenství je díky vysokým hladinám progesteronu snížena mitotická aktivita buněk.
Nádory prsu
Estrogeny mohou indukovat a podporovat rozvoj nádorů mléčné žlázy (experimentální důkazy u hlodavců). Rizikovými faktory je zejména kumulované působení estrogenů. Raný nástup menstruace a pozdní menopauza maximalizují počet ovulačních cyklů. Naopak prodloužená laktace a fyzická aktivita mohou počet cyklů redukovat (oddaluje se počátek menstruace, redukuje se frekvence ovulačních cyklů a hladiny cirkulujících enzymů). Také vysoká konzumace alkoholu (více než 60 g alkoholu denně) je spojována s lineárním vzrůstem nádorů u žen. Alkohol totiž může zvyšovat hladinu estrogenu v plazmě a hladinu tzv. „insulin-like“ růstového faktoru. Primárním zdrojem estrogenu u žen po menopauze je přeměna androstendionu na estron v tukové tkáni.
Nádory prostaty
V karcinogenezi prostaty hraje úlohu biosyntéza, aktivace, inaktivace a transport androgenů. Důležitým rizikovým faktorem je věk a etnicita. Např. v populaci Afroameričanů byl zaznamenán nejvyšší výskyt nádorů prostaty. Jako chemoprevence působí finasterid.
Exogenní hormony
Existují rozsáhlé zdroje vnějších zdrojů steroidních hormonů. Patří k nim právě hormonální náhradní terapie (HRT) a antikoncepce. Antikoncepce zahrnující estrogen a vysoké dávky progesteronu může snižovat riziko vaječníků a dělohy. HRT může zvyšovat riziko nádorů prsu, ale důkazy jsou mnohdy protichůdné. Riziko představuje zejména u žen s rodinou anamnézou nádorů prsu.
Řada tzv. „hormon-like“ přírodních látek může vykazovat také např. estrogenní aktivitu.
Poznatky o úloze hormonů v karcinogenezi však neumožňují jednoduše řešit tento fenomén, protože to není tak lehce modulovatelný faktor jako třeba kouření. Jednoduše nemůžeme odstranit nebo snížit endogenní hormony. Nové strategie pro detekci a prevenci zahrnují poznání biomarkerů zvýšeného rizika, např. specifický genotyp a nové způsoby chemoprevence.
Polygenní model a biomarkery
Přestože existují důkazy, že sekrece hormonů a jejich metabolizmus může být ovlivněn zvenčí (např. dietou, fyzickou aktivitou), velkou úlohu hraje genetická regulace. Proto je důležité charakterizovat geny, které odpovídají za interindividuální rozdíly v hladině hormonů a jsou zahrnuty v metabolizmu a transportu hormonů. Předpokládá se multigenový model predispozice k nádorům prsu, který obsahuje několik genů zahrnutých v biosyntéze, vazbě a transportu estrogenů. Individuální rozdíly vycházejí z polymorfizmu těchto zásadních genů.
Genetický základ hladiny hormonů je důležitým rizikovým faktorem (polymorfizmus metabolických genů) a dále se uplatňují různé vnější faktory ovlivňující hladinu hormonů (dieta, fyzická aktivita). Důležité je charakterizovat geny odpovídající za interindividuální rozdíly v hladině hormonů a zahrnuté v metabolismu a transportu hormonů.
Kontrolní otázky k tématu
Jaké endogenní faktory se mohou uplatňovat v karcinogenezi?
Jakým způsobem?Popište mechanizmus přenosu signálu a působení steroidních hormonů.
Která nádorová onemocnění a jak závisejí na hormonech?
Jak se uplatňuje v hormonální karcinogenezi genetická složka?
Jaké existují možné vnější zdroje hormonů?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

