Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Kontrola krvetvorby (hemopoézy) a leukémie
Sebeobnovné buněčné populace
Krvetvorná tkáň patří mezi tzv. sebeobnovné buněčné populace podobně jako kožní a střevní epitel či zárodečné populace. Tyto tkáně se vyznačují hierarchickou strukturou, kde jsou v jednotlivých kompartmentech multi- nebo pluripotentní kmenové buňky, progenitorové buňky a zralé diferencované buňky (obr. 12-1).
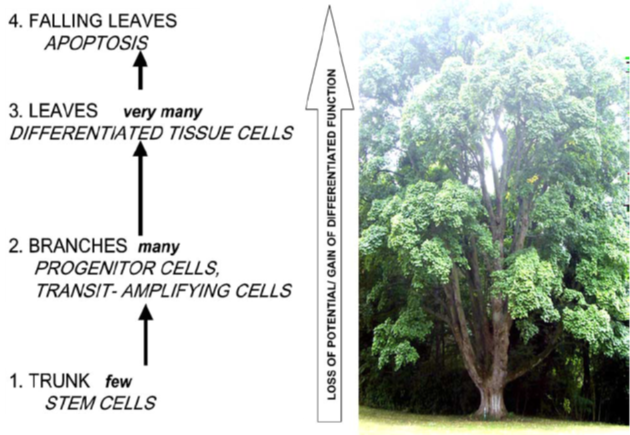
Obr. 12-1 Linie kmenových buněk v dospělé tkáni a normální obnova tkání
(analogie s kmenem, větvemi a listy stromu)
(Sell S., Crit Rev Oncol Hematol 2004 : 1)
Multi/pluripotentní nejprimitivnější hematopoetická buňka je klidová kmenová buňka reagující na stres. Z ní vzniká většina proliferujících buněk v kostní dřeni (progenitory).
Tyto kmenové buňky se vyznačují schopností asymetrického dělení, kdy dávají vznik jedné nové dceřinné kmenové buňce (sebeobnova) a druhé dceřinné buňce se schopností diferenciace (obr. 12-2). Vznikají z ní progenitorové přechodně se dělící (transit-amplifying) a více diferencované buňky, které postupně dozrávají v terminálně diferencované buňky (lymfoidní a myeloidní řady), které se přestávají dělit, jsou udržovány v klidové G0 fázi a umírají apoptózou (obr. 12-3).
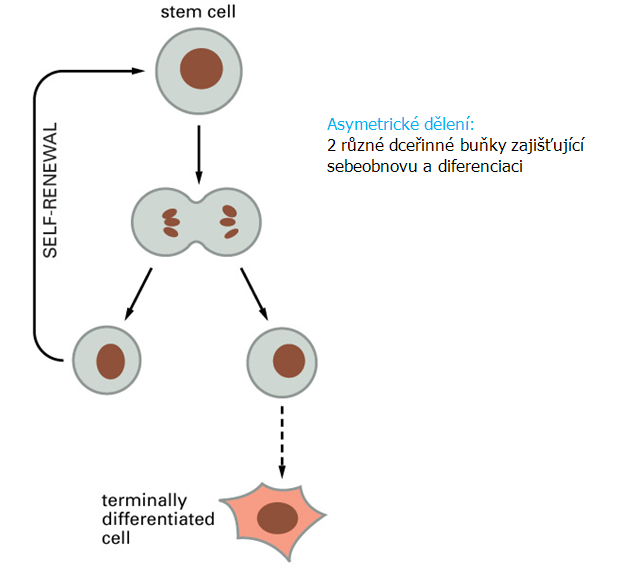
Obr. 12-2 Definice kmenové buňky
(Figure 22-4. Molecular Biology of the Cell, 4th Edition.)
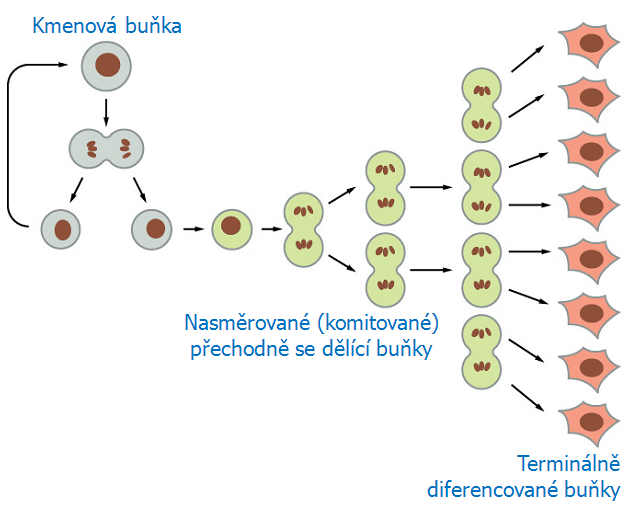
Obr. 12-3
(Figure 22-7. Molecular Biology of the Cell, 4th Edition.)
V tomto systému je nutné, aby byla dodržována přísná rovnováha počtu a typů buněk v jednotlivých kompartmentech lymfoidní a myeloidní řady (obr. 12-4). Při udržování rovnováhy mezi proliferací, diferenciací a apoptózou se uplatňují mezibuněčné interakce, stimulační a inhibiční signály, diferenciační a viabilitní faktory, které jsou specifické pro jednotlivé fáze vývoje a určité typy krvetvorných buněk (obr. 12-5).
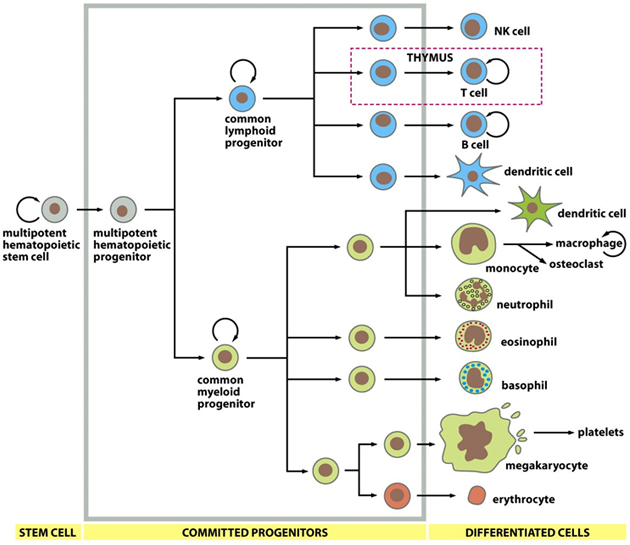
Obr. 12-4 Sebeobnovná krvetvorná tkáň
(Figure 22–35. Molecular Biology of the Cell, 4th Edition)
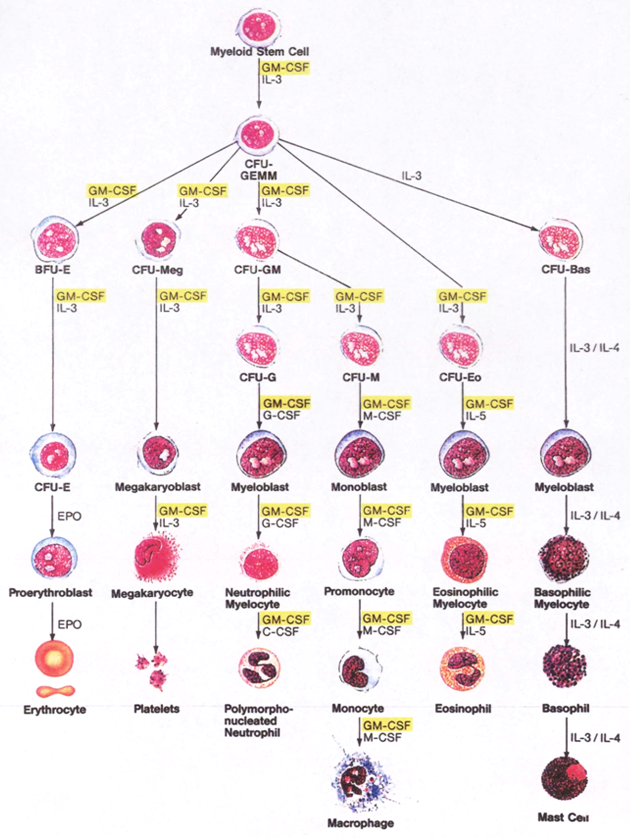
Obr. 12-5 Specifické růstové a viabilní faktory
V normální buňce je rovnováha stimulačních a inhibičních signálů pečlivě regulována, což také souvisí s regulací buněčného cyklu, který je rozhodující pro buněčnou proliferaci a diferenciaci. V nádorové buňce je v důsledku změn v signálních drahách organizace buněčného cyklu narušena, buňky se neomezeně množí a nejsou schopny diferenciace (obr. 12-6). Buňka je vybavena také zpětnovazebnými mechanizmy, které mohou působit proti neobvyklým změnám v procesu buněčného dělení. Patří k nim např. programovaná buněčná smrt - apoptóza, schopnost buňky spáchat za určitých podmínek sebevraždu, jestliže její základní komponenty jsou porušeny nebo když je její kontrolní systém deregulován. Tak působí např. poškození chromozomální DNA. V tomto procesu se účastní také specifické geny např. p53 nebo bcl-2. Mutace těchto genů pak způsobují poruchy apoptózy a neschopnost apoptózy přispívá ke vzniku nádorů a k jejich rezistenci k terapii.
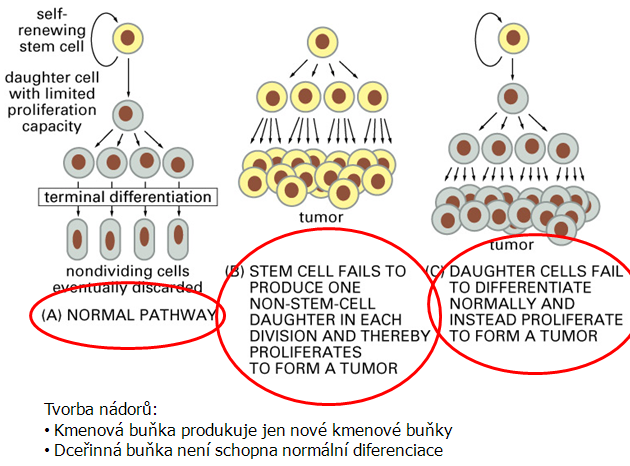
Obr. 12-6 Normální a narušená kontrola produkce z kmenové buňky
(Figure 23-14. Molecular Biology of the Cell, 4th Edition.)
Změny v počtu buněk je třeba interpretovat jako změny buněčné kinetiky, tj. sledování změn v čase. Tvorba terminálně diferencovaných buněk z časných buněčných prekurzorů trvá asi 4–8 dnů (3–6 mitotických dělení). Tyto buňky pak setrvávají v periferní krvi asi 10 hodin (neutrofilní leukocyty), 10 dnů (trombocyty) nebo více než 100 dnů (erytrocyty). Schopnost produkce kmenových buněk, z nichž každý den vzniká asi 3 × 1011 funkčních buněk se může zvýšit v případě potřeby až desetkrát.
S produkcí různých typů krvetvorných buněk souvisí i různé poruchy a patologické stavy jako je anemie (snížená produkce erytrocytů) či polycytemie (zvýšená produkce erytrocytů). Kvantitativní poruchy se mohou týkat různých úrovní diferenciace erytrocytů. Trombocytopenie a trombocytemie jsou poruchy produkce trombocytů a jsou následkem poruchy tvorby nebo ploidie megakaryocytů. Neutropenie jsou poruchy granulocytárního systému. Periferní neutropenie mohou být způsobeny zrychleným odbouráváním buněk, poruchou v jejich produkci nebo změnou jejich distribuce. Neutrofilní leukocytózy jsou podmíněny nadprodukcí nebo přesunem mezi kompartmenty (CML – příklad klonálně podmíněné leukocytózy). Lymfopenie a lymfocytózy jsou poruchy lymfocytů (CLL). Jako pancytopenie je označována kvantitativní porucha několika buněčných systémů. Aplastická anemie znamená obecné snížení hematopoetických buněk v kostní dřeni.
Leukemie a lymfomy
Leukémie vzniká jako nekontrolovaná proliferace nebo expanze hematopoetických buněk, které si neudrží schopnost normálně se diferencovat do zralých krevních buněk.
Onemocnění je silně heterogenní s odlišnými epidemiologickými, histologickými, cytologickými, imunologickými a genetickými charakteristikami. Liší se projevy, stupněm malignity a odpovědí na léčbu. Vzniká na různých úrovních vývoje hematopoetických buněk (obr. 12-7). Mechanizmy iniciace a progrese leukémií souvisejí se změnami v normálním homeostatickém mechanizmu, který reguluje produkci krevních buněk. V tomto procesu se významně uplatňují rovněž poruchy genů regulujících buněčný cyklus. Tyto geny se různě exprimují v postupných fázích vývoje hematopoetických buněk a kontrolují diferenciaci (obr. 12-8, 12-9).
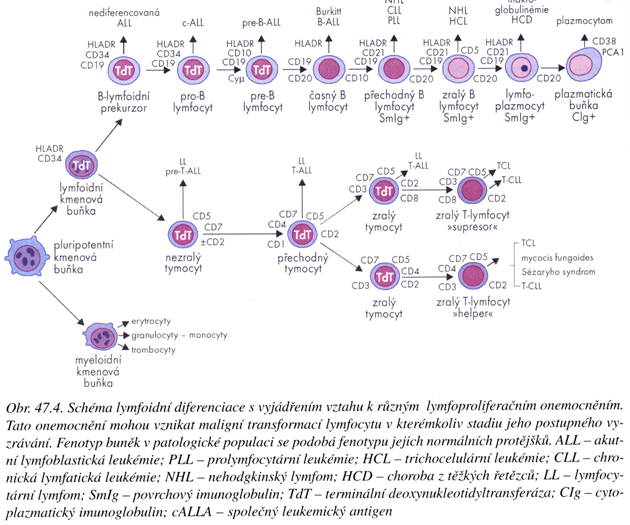
Obr. 12-7 Schéma lymfoidní diferenciace s vyjádřením vztahu k různým lymfoproliferačním onemocněním
(P. Klener: Klinická onkologie, 2002)
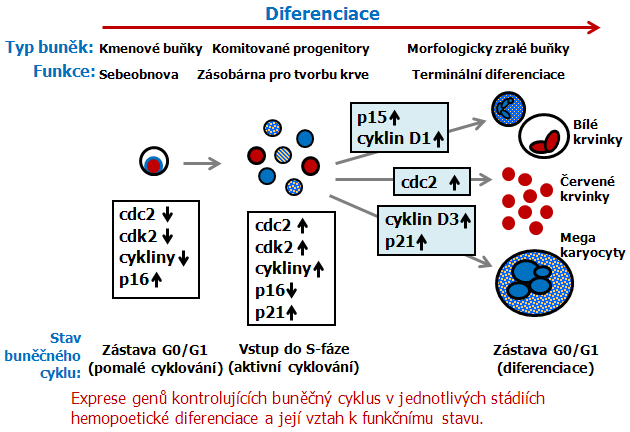
Obr. 12-8 Geny kontroly buněčného cyklu v hemopoéze
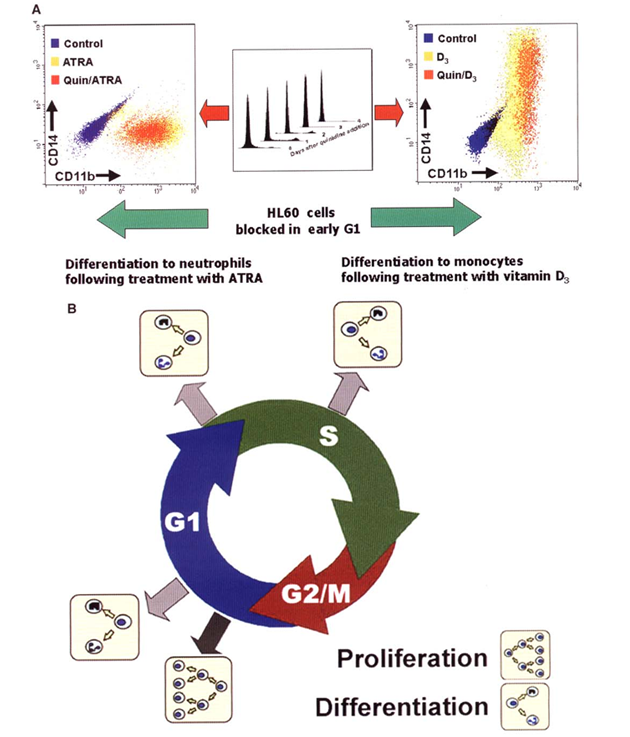
Obr. 12-9 Vztah mezi buněčným cyklem a diferenciací
Většina leukémií je klasicky rozdělována na lymfoidní a myeloidní. Některé poruchy hemopoézy nejsou striktně leukemické, protože vyjadřují jen část plného leukemického fenotypu - buď expanzi růstu (myeloproliferační syndromy) nebo diferenciační blok (myelodysplasie) (obr. 12-10). Leukemická onemocnění se vyskytují v dětském i dospělém věku. Mnohdy jsou těžko definovatelné. Pro dobrou klasifikaci důležitou jak pro prognózu tak léčbu jsou využívány různé systémy – zejména tzv. imunofenotypizace pomocí spektra charakteristických buněčných povrchových (CD) antigenů.
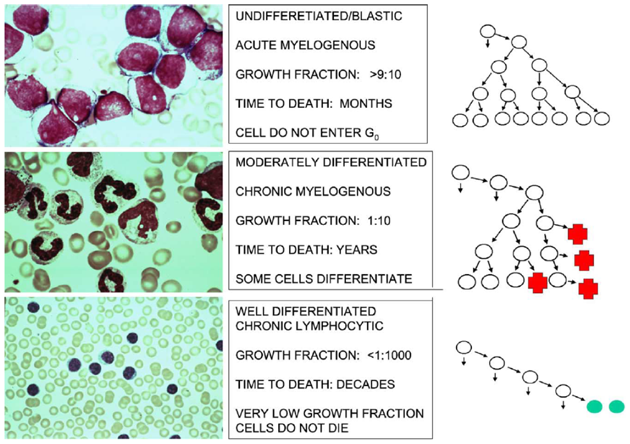
Obr. 12-10 Růstová frakce, morfologie a klinický průběh tří typů leukémií
(akutní myeloidní leukémie, chronická myeloidní leukémie, chronická lymfocytární leukémie)
(P. Klener: Klinická onkologie, 2002)
Všechny elementy krve a lymfy jsou odvozeny během fetálního a dospělého života od pluripotentní hematopoetické kmenové buňky. Tyto buňky se nacházejí v malém počtu v kostní dřeni a většina z nich se aktivně nedělí. Pokrok v izolaci a charakterizaci pluripotentní kmenové buňky pomáhá k poznání s ní souvisejících malignit. Lidské kmenové buňky nesou povrchový znak CD34 a jsou schopny tvořit řadu kolonií v semisolidním prostředí v odpověď na různé specifické růstové faktory. Jisté lidské leukemické buňky, jako ty z chronické myeloidní leukémie (CML) nebo akutní myeloidní leukémie (AML), které představují velmi nezralé kmenové buňky nebo prekurzory jednotlivých linií, se jen velmi obtížně kultivují in vitro, přestože v pacientech rostou velmi rychle. Chybí asi specifické faktory dodávané mikroprostředím kostní dřeně.
Byl objeven nový tzv. steel faktor produkovaný stromálními buňkami a jeho receptor c-kit přítomný na řadě hematopoetických buněk. U myší byly definovány dva genetické lokusy regulující vývoj kmenové buňky - steel (SL) a white-spotting (W). W lokus kóduje c-kit onkogen, což je člen třídy onkogenů pro tyrozin kinázové receptory. Je to receptor pro produkt genu Sl, který vykazuje růstově promoční aktivitu pro mnoho hematopoetických línií a synergii s dalšími růstovými a diferenciačními faktory jako GM-CSF, Epo a IL-7. Sl faktor je považován za kritický pozitivní efektor růstu a vývoje kmenových buněk. Proto je věnována pozornost jeho roli v růstové regulaci u leukemií, které představují primitivní typy kmenových buněk.
U kmenových buněk CD34 jsou málo exprimovány transkripční faktory. Působením blíže nedefinovaných signálů, jako je vliv interakce ve stromatu nebo signály růstových faktorů, dochází ke zvýšené expresi specifických transkripčních faktorů např. GATA-1 nebo PU.1. To vede k jejich autoregulaci a zvýšené expresi specifických receptorů pro růstové faktory, což má za následek vzestup proliferace, diferenciace a supresi apoptózy specifických linií. Snížená exprese specifických faktorů (jako je GATA-1 během myeloidního vývoje) může také hrát důležitou úlohu. U lidských i živočišných leukémií byly identifikovány geny homologní se známými transkripčními aktivátory. Některé hrají roli v diferenciaci hematopoetických buněk, protože jsou homologní nebo identické s geny dříve identifikovanými v jiných experimentálních systémech jako geny ovlivňující vývoj a diferenciaci. Existuje tedy vazba mezi onkogenezí a transkripční deregulací (obr. 12-11).
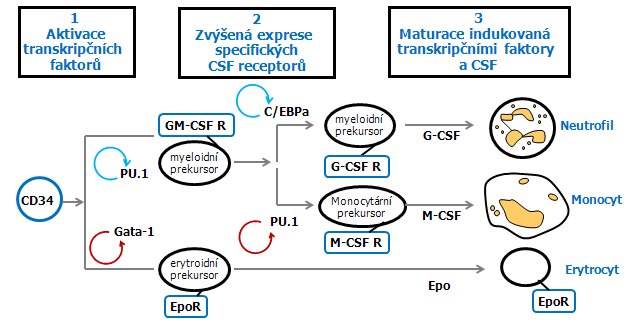
Obr. 12-11 Model indukce hematopoetické diferenciace specifickými transkripčními faktory
(podle Tenen D.G., Blood 1997 : 489)
Linie výzkumů mechanizmů působení retroviru indukujícího erytroleukémii vedlo k odhalení, že virové proteiny mohou stimulovat růst hostitelských buněk tím, že působí jako pseudoligandy pro receptory růstových faktorů.
Poměrně dobře je objasněna úloha stromatu kostní dřeně v regulaci normální krvetvorby. Byly vytvořeny dlouhodobé kultury pro myeloerytroidní a lymfoidní vývoj. Řada údajů předpokládá, že vzájemné kontakty buněk a specifické účinky mimobuněčné matrix pomáhají regulovat vývoj kmenové buňky. Různé typy leukémií se mohou lišit od normálních protějšků tím, že nevyžadují dále blízký buněčný kontakt pro růstovou expanzi a cirkulaci v krvi (obr. 12-12). Existují údaje o negativních regulátorech kmenových i líniově specifických buněk, např. TGF beta produkovaný stromálními buňkami. Stojí za to věnovat pozornost tomu, jak kmenové buňky a různé leukemie unikají této negativní kontrole.
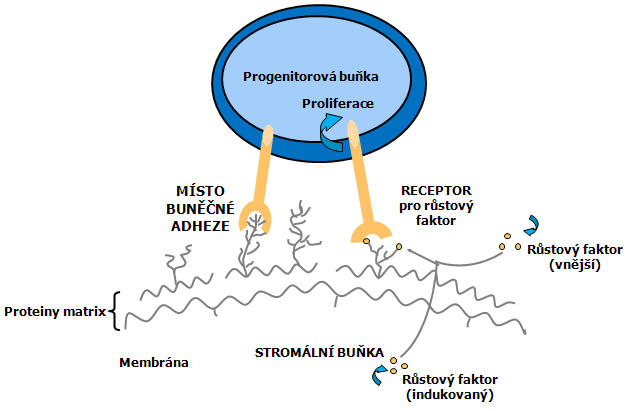
Obr. 12-12 Model prostorové organizace hematopoetických kmenových buněk a růstových faktorů v mikroprostředí kostní dřeně
Při vývoji buněk kostní dřeně existuje kontrola a rovnováha, která limituje celkovou buněčnost a odpověď na stresy jako záření, krvácení apod. Interakce sítě cytokinů produkovaných různými typy krevních buněk zajišťují kontrolu pomocí pozitivní a negativní zpětné vazby (obr. 12-13).
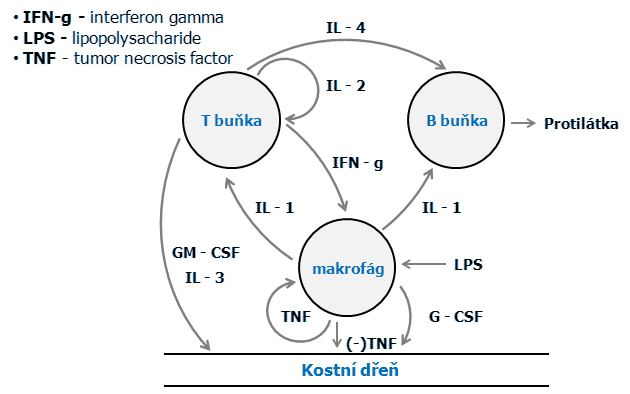
Obr. 12-13 Síť interakce cytokinů, pozitivní a negativní zpětná vazba
CML – chronická myeloidní leukémie
CML je klonální myeloproliferativní porucha primitivních hematopoetických kmenových buněk. Zahrnuje myeloidní, erytroidní, megakaryocytární, B- někdy T-lymfoidní elementy, ale ne např. fibroblasty kostní dřeně. Nemoc je silně heterogenní, má 2 až 3 fázový průběh.
CML buňky mají charakteristické cytogenetické (Philadelphia -Ph chromozóm) a molekulární (bcr-abl zfúzovaný gen) znaky. Chromozomální abnormalitu představuje translokace t(9,22) c-abl tyrozin kinázového protoonkogenu do jisté oblasti velkého genu nazývaného bcr, čímž je aktivována tyrozin kinázová aktivita c-abl a konvertuje abl na transformující protein hematopoetických buněk (obr. 12-14).
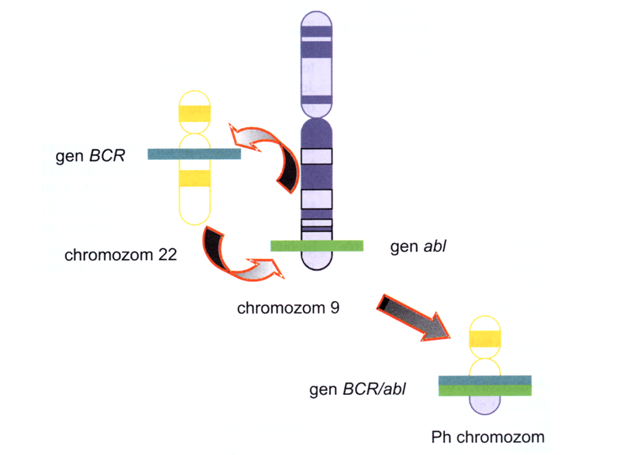
Obr. 12-14 Ph chromozom je produktem translokace t(9;22)(a34;q11). Na Ph chromozómu vzniká fúzní gen BCR/abl, který se významně podílí na maligní transformaci hematopoetických prekurzorů.
(Z. Adam, J. Vorlíček, J. Koptíková: Obecná onkologie a podpůrná léčba, 2003)
CML je nemoc kmenové buňky, protože Ph chromozóm je nalézán ve všech hematopoetických liniích maligních pacientů, ale ne už v kožních fibroblastech nebo stromálních buňkách. Klinickým fenotypem choroby je expanze myeloidního kompartmentu během iniciační fáze, ale udržení plné diferenciace. CML v chronické fázi vykazuje klonální expanzi normálně se diferencujících granulocytů a je původně benigní poruchou (obr. 12-15).
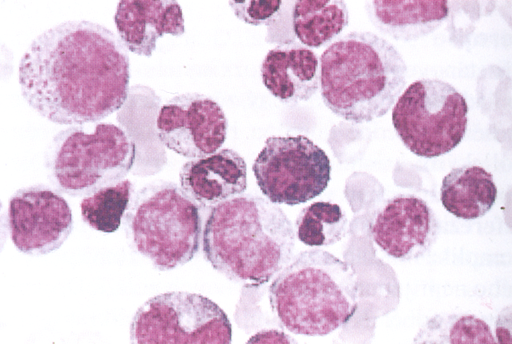
Obr. 12-15 Chronická myeloidní leukemie
(P. Klener: Klinická onkologie, 2002)
Původní (chronická) fáze je následována eventuální progresí do akutní leukémie charakterizované cirkulujícími nediferencovanými lymfoidními nebo myeloidními blastovými buňkami (obr. 12-16). Ph chromozóm je nalézán také u 20 25 % dospělých a 5 % dětí s akutní lymfoblastickou leukémií (ALL). Zdá se, že tato nemoc vychází spíše z lymfoidních prekurzorů než z kmenové buňky.
U akutní leukémie dochází jak k růstu počtu cirkulujících bílých krvinek, tak k poruše normálního zrání a funkce. Některé neleukemické poruchy krve, jako jsou myeloproliferační nebo myelodysplastické syndromy, mají jen jednu nebo jiné z těchto abnormalit, ale obě mohou vyústit v akutní myeloblastickou leukémii (AML). Plná leukemická transformace vyžaduje defekt jak v růstu tak v diferenciaci.
Asi 5–10 % akutních leukémií nemůže být klasifikováno jako lymfoidní nebo myeloidní, protože vykazují povrchové markery i histochemické vlastnosti obou linií. Původ těchto leukémií není zcela objasněn.
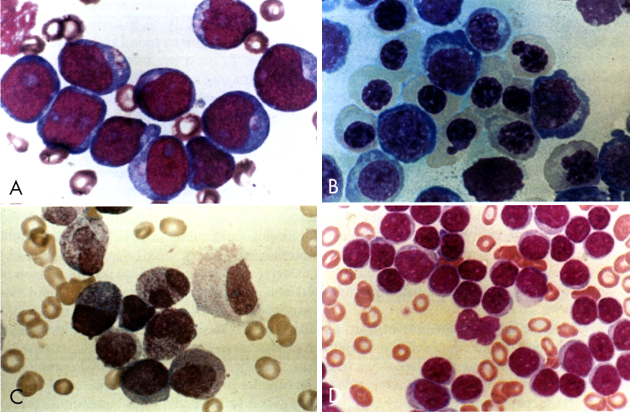
Obr. 12-16 Kostní dřeň u akutních leukémií
B – akutní myeloblastová leukémie (M2)
C – akutní myeloblastová leukémie (M3)
D – akutní lymfoblastická leukémie
(P. Klener: Klinická onkologie, 2002)
Myelodysplastický syndrom (MDS)
MDS je preleukemie, která představuje poruchu diferenciace charakterizovanou malými počty cirkulujících krevních buněk. Kostní dřeň pacientů ukazuje normální nebo mírně zvýšené počty prekurzorů, které však nezrají normálně. Morfologicky vykazují asynchronii zrání jádra a cytoplazmy. U MDS jsou velmi časté chromozomální abnormality. Zvláště ztráta části dlouhých ramen chromozómů 5 a 7 indikuje vysoké riziko leukemické transformace. Na 5 chromozómu jsou lokalizovány geny řady růstových faktorů a jejich receptorů. Změna nebo ztráta těchto genů může hrát roli v MDS nebo existuje ještě neobjevený supresorový gen v této oblasti, který je inaktivován.
Akutní leukemie
Akutní lymfoblastické leukemie (ALL) představují akumulaci nezralých lymfoidních buněk v kostní dřeni. Tato onemocnění vznikají maligní transformací lymfocytů v kterémkoli stadiu jejich dozrávání a dle toho jsou klasifikována. Objevují se převážně u dětí a tvoří asi 80 % všech leukemií dětského věku a asi 25 % všech dětských nádorů. Prognóza je relativně příznivá. U dospělých staršího věku tvoří asi 20 % všech akutních leukemií s méně příznivou prognózou. ALL představují řadu subtypů lišících se v odpovědi k terapii a riziku relapsu v závislosti na diagnostickém karyotypu. Rozlišujeme dva základní typy – B-ALL nebo T-ALL.
Nejčastější cytogenetickou abnormalitou u dětí (25–30 %) je polysomie charakterizovaná výskytem více než 50 chromozómů (masivní hyperdiploidie) v leukemických buňkách bez dalších strukturálních karyotypových abnormalit. Tato cytogenetická vlastnost je spojena s dobrou prognózou příslušné odpovídající léčby. Nejčastěji jsou detekovány na chromozómech 21 (většinou tetrasomie), X, 6, 14, 4, 18, 17 a 10 (obr. 12-17).
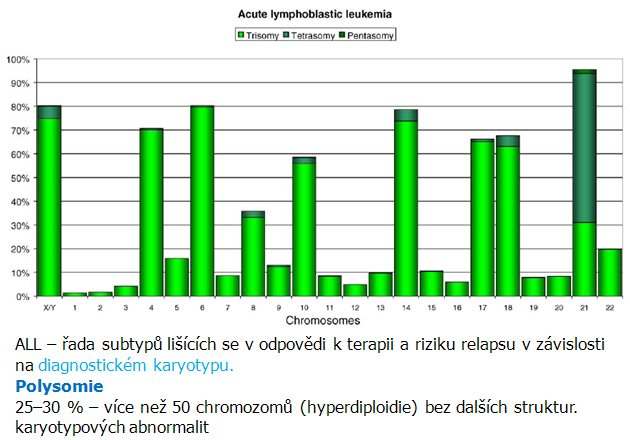
Obr. 12-17 Akutní lymfoblastická leukémie
(Teixeira M. R. and Heim S., Seminars in Cancer Biol 2005 : 3)
Akutní myeloidní leukemie (AML) je nejčastější leukemické onemocnění dospělých. Tvoří až 85 % všech akutních leukémií u osob starších 20 let. Prognóza se v posledních letech zlepšila. Pro AML jsou charakteristické genetické změny vedoucí ke konstitutivní aktivaci receptoru pro IL-3, následované aktivací tyrozinových kináz a podporou proliferace. Konstitutivní aktivace IL-3 receptoru podporuje růst všech typů myeloidní řady (obr. 12-18).
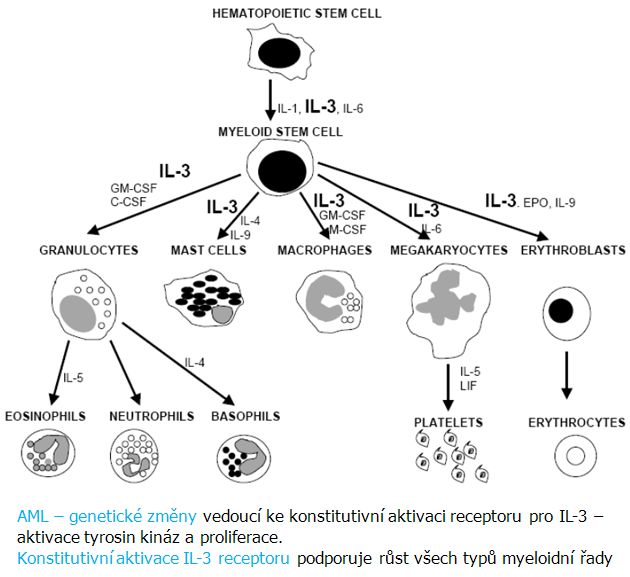
Obr. 12-18 Akutní lymfoblastická leukémie
(Sell S., Crit Rev Hematol Oncol, 2004 : 1)
B-lymfomy, Burkittův lymfom
U tohoto onemocnění se jedná o rychlý nárůst nezralých B buněk, které neumírají. Je spojeno s translokací a aktivací imunoglobulinového (Ig) promotoru spolu s aktivací onkogenů c-Myc (podpora proliferace) a Bcl-2 (blok apoptózy). Genetická změna je přítomna v kmenové bunňce, ale růst nádoru je určen stadiem maturace, kde dojde k aktivaci Ig promotoru (obr. 12-19, 12-20).
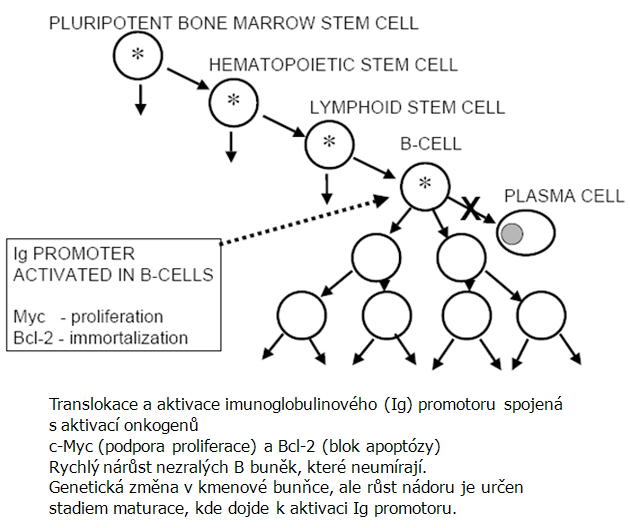
Obr. 12-19 B-lymfomy, Burkittův lymfom
(Sell S., Crit Rev Hematol Oncol, 2004 : 1)
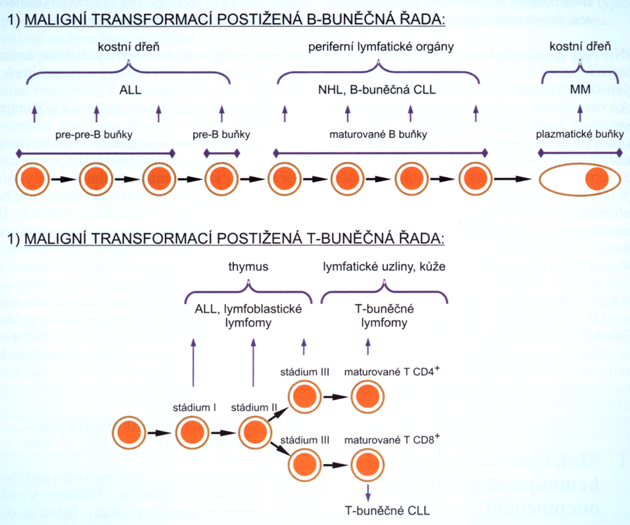
Obr. 12-20 Typ hematoonkologického onemocnění, které se bude vyvíjet, závisí na vývojovém stadiu lymfoidní prekurzorové buňky zasažené maligní transformací.
(Z. Adam, J. Vorlíček, J. Koptíková: Obecná onkologie a podpůrná léčba, 2003)
Non-hodgkinské lymfomy (maligní lymfomy, NHL)
Lymfomy vznikají nádorovou transformací buněk lymfoidních tkání. Klasifikace je obtížná a někdy není rozdíl mezi leukemií a lymfomem jasný. U dětí představuje asi 12 % a u dospělých 3–4 % všech zhoubných nádorů.
Diagnostika, léčba, terapeutické využití cytokinů
Zlepšující se znalosti v oblasti biologie a imunologie hostitele a nádorové patofyziologie umožnily využít další nové přístupy v terapii nádorových pacientů. Patří k nim stimulace obranných mechanizmů hostitele včetně specifických a nespecifických imunologických přístupů a strategie cílené přímo na změnu nádorového růstu a diferenciace terapeutickým ovlivněním patofyziologických mechanizmů.
Velmi důležitá je dobrá počáteční diagnostika onemocnění a monitorování úspěšnosti léčby. K nejdůležitějším vyšetřením patří, tzv. imunofenotypizace dle souboru povrchových znaků – CD antigenů - charakteristického pro určitý typ buněk periferní krve a kostní dřeně, tzv. imunofenotyp (obr. 12-21). Využívá se stanovení imunohistochemické a imunocytochemické, kdy se řezy tkání, nátěry a antigeny znázorňují protilátkou vizualizovanou zpravidla enzymatickou reakcí. Tyto metody umožňují i současné stanovení morfologie buněk a vyšetření tkání.
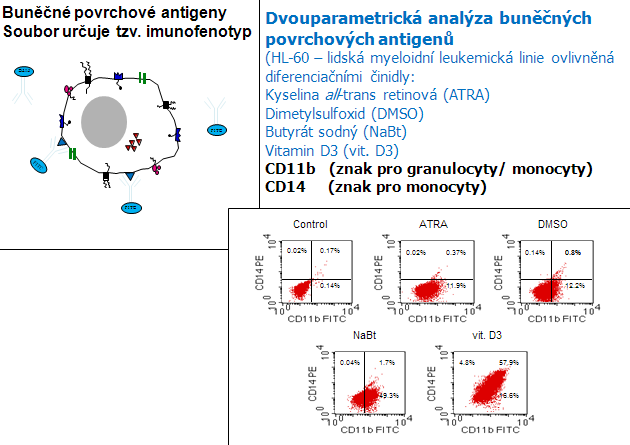
Obr. 12-21 Dvouparametrická analýza buněčných povrchových antigenů
(Karel Souček, 2000)
Metoda imunofluorescence umožňuje detekovat zkoumané antigeny pomocí specifických fluorescenčně značených protilátek (fluorochromy, imunofluorescence, přímé nebo nepřímé značení). Je to rychlá metoda využívající široké spektrum protilátek a umožňuje detekci v buněčných suspenzích – krev, kostní dřeň, výpotky, mozkomíšní mok, suspenze ze solidních tkání. Využívají se tzv. kokteily protilátek, to znamená, že jedním fluorochromem je značeno více protilátek i kombinace více protilátek proti různým epitopům jednoho antigenu. Ke stanovení fluorescence se používá fluorescenční mikroskopie, ale v současné době především vícebarevná průtoková cytometrie (obr. 12-22 až 12-25).
Becton Dickinson Instruments (BD)

The FACSCalibur is the first a 4-colour, dual laser, benchtop system capable of both cell analysis and sorting fully integrated multiparameter system, wide range of research and clinical applications.

High performance, high speed cell sorter Flow sorting instrument for the research laboratory.

the first 6-Color Benchtop Research Flow Cytometer
It has combined benchtop easy-of-use with the flexibility and performance of high-end flow cytometers.
Building on the easy-of-use standard set by the FACSCalibur, the BD LSR offers software instrument Control, push button fluids, and fine-adjust sample flow-rate control.
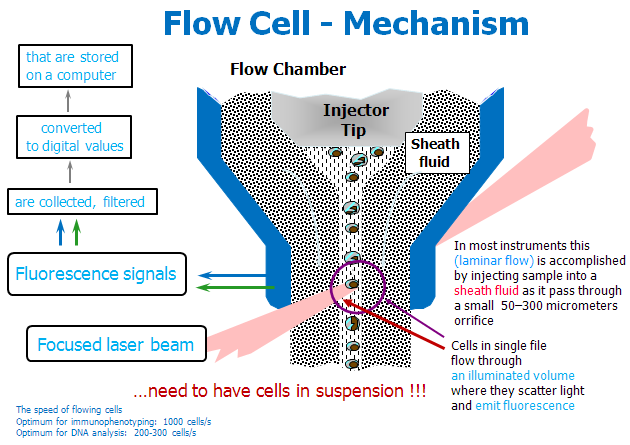
Obr. 12-23 Flow Cell – Mechanism
(Purdue University Cytometry Laboratories, http:/www.cyto.purdue.edu/flowcyt/educate.htm)
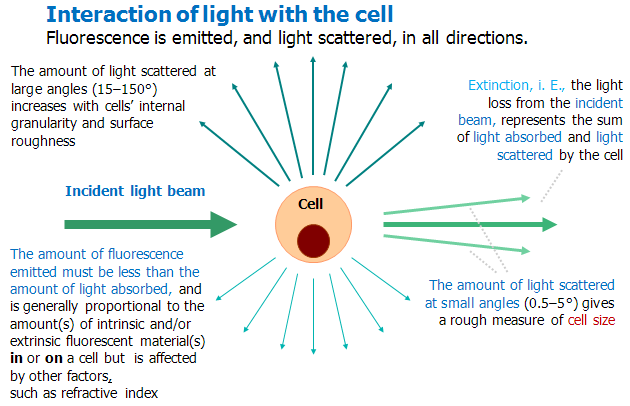
Obr. 12-24 Interaction of light with the cell
(Purdue University Cytometry Laboratories)
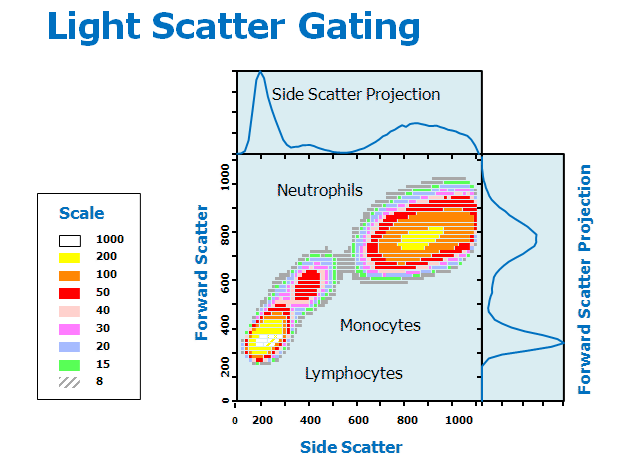
Obr. 12-25 Light Scatter Gating
(Purdue University Cytometry Laboratories)
Výpovědní hodnotu má i mikroskopické stanovení dle morfologie buněk a molekulárně biologické metody, např. FISH (fluorescenční in situ hybridizace), detekující genetické abnormality (obr. 12-26).
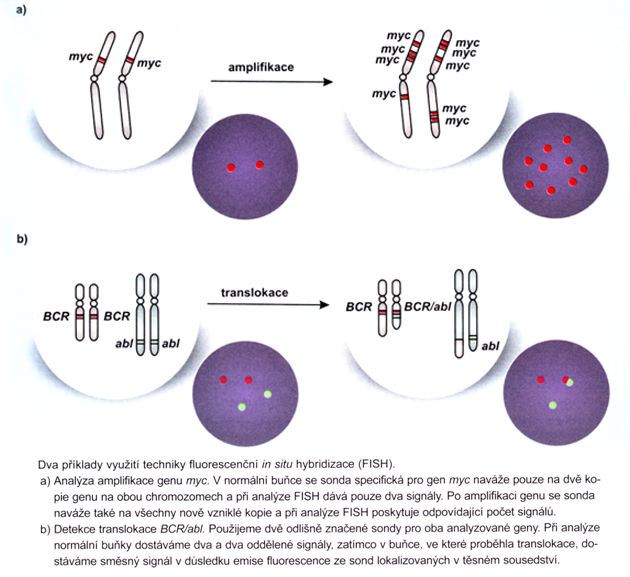
Obr. 12-26 In situ fluorescenční hybridizace (FISH)
(Z. Adam, J. Vorlíček, J. Koptíková: Obecná onkologie a podpůrná léčba, 2003)
Hematopoéza je regulována více než 20 dobře charakterizovanými faktory definovanými jako kolonie stimulující faktory (CSF), interleukiny (IL) a cytokiny. Některé z těchto faktorů jsou běžně používány, ale potenciální klinické využití není úplně objasněno. Využívají se faktory uplatňující se v pozitivní i negativní regulaci, v autokrinním růstu a imunomodulační látky.
Vytvoření kultivačních systémů pro klonální vývoj hematopoetických buněk umožnilo odhalit proteiny, které regulují buněčnou viabilitu, růst a diferenciaci různých hematopoetických línií a také molekulární základy normálního a abnormálního vývoje krvetvorných tkání. Různé cytokiny indukují viabilitu, množení a diferenciaci a hemopoéza je kontrolována sítí interakcí cytokinů. Tato multigenová síť zahrnuje pozitivní regulátory jako jsou CSF a IL a negativní regulátory jako TGF beta a TNF. Síť cytokinů, která vznikla během evoluce umožňuje značnou flexibilitu závisející na tom, která část sítě je aktivována a na okamžitém zesílení odpovědi na příslušný stimul. CSF a IL indukují buněčnou viabilitu inhibicí programované buněčné smrti - apoptózy. Ta je též regulována geny jako p53, c-myc a bcl-2 a suprese nebo indukce tohoto programu může vyústit v podporu nebo supresi nádoru. Cytokiny, které regulují normální hematopoézu mohou kontrolovat abnormální růst jistých typů leukemických buněk a potlačovat malignitu indukcí diferenciace. Genetické abnormality, z nichž vzniká malignita, jsou tak obcházeny a jejich účinek anulován indukcí diferenciace a apoptózy. Hematopoetické cytokiny objevené in vitro jsou aktivní in vivo a jsou klinicky využívány.
Pozitivní regulace hemopoézy
Prvním cytokinem využitým v terapii byl erytropoetin a to
při stimulaci erytropoézy po chemoterapii a transplantaci kostní dřeně,
u některých lymfoproliferačních poruch jako mnohočetné myelomy a chronická lymfocytární leukémie,
u anémií spojených s chronickým onemocněním (nádory, AIDS),
v programech autologního odběru krve.
Také G-CSF a GM-CSF mají řadu klinických aplikací:
urychlení zotavení krvetvorby po chemoterapii,
zlepšení sběru progenitorů z periferní krve,
zvýšení účinnosti cytotoxických léčiv vybuzením klidových leukemických buněk,
stimulace hematopoézy u syndromů poruch v kostní dřeni jako je cyklická neutropenie či aplastická anémie,
aktivace efektorových buněčných funkcí (AIDS, poruchy funkce leukocytů).
V mnoha klinických studiích aplikace G-CSF a GM-CSF zabraňuje nebo redukuje neutropenii po chemoterapii a zvyšuje počty neutrofilů u primárních poruch kostní dřeně.
IL-3 nazývaný multi-CSF podporuje přežívání in vitro, proliferaci a vývoj multipotentních hematopoetických kmenových buněk a komitovaných progenitorů pro granulocyty a makrofágy, erytrocyty, megakaryocyty, eosinofily a basofily.
Negativní regulace hemopoézy
Využití negativních regulátorů hemopoézy představuje zcela jiný přístup založený na prevenci poškození ochranou pluripotentních kmenových buněk proti cytotoxickému působení chemoterapeutik. Patří k nim např. TGF beta a MIP 1alfa (macrophage inflammatory protein), které tlumí proliferaci kmenových buněk během fáze působení chemoterapeutik a chrání je tak před poškozením.
Růstové faktory a autokrinní růst
Autokrinní růst je definován jako vývoj malignity buňky endogenní produkcí vlastního stimulačního faktoru, což způsobí její nezávislost na vnější fyziologické kontrole růstu. Autokrinní růstový faktor se tvoří v jádře a je uvolňován buňkou. Ta na svém povrchu nese receptory pro tento faktor, přes které je buňka další komplikovanou cestou přenosu signálu nucena k další produkci růstového faktoru, čímž se zvyšuje její malignita. Proto je cílem terapie blokáda těchto cest různými antagonisty růstových faktorů a receptorů a látkami, které zasahují do sítě přenosu signálu. Nyní dochází v této oblasti k velkému rozmachu a hledají se nové látky působící na buněčné membráně. Patří k nim inhibitory inositol lipidového metabolizmu, eterové lipidy, antagonisty PAF (platelet-activating factor), inhibitory protein kinázy C atd. Další strategie zahrnuje indukci diferenciace nádorových buněk a navození apoptózy.
Léčebné postupy
U pacientů s CML byla v minulosti prognóza velmi špatná (střední doba přežití 3 roky). Nyní se situace zlepšila díky včasné diagnóze, zlepšující se terapii a podpůrné léčbě. K léčbě se využívá hydroxyurea s busulfanem podporovaná IFN, ARA-C a dále autologní transplantace kostní dřeně (obr. 12-27). Střední doba přežití je asi 60–65 měsíců. Po léčbě IFNalfa přežívá 20–25 % pacientů. Léčba má však vedlejší účinky jako je horečka, nechutenství, svalové bolesti i dlouhodobější problémy jako je ztráta váhy, deprese, nespavost atd.
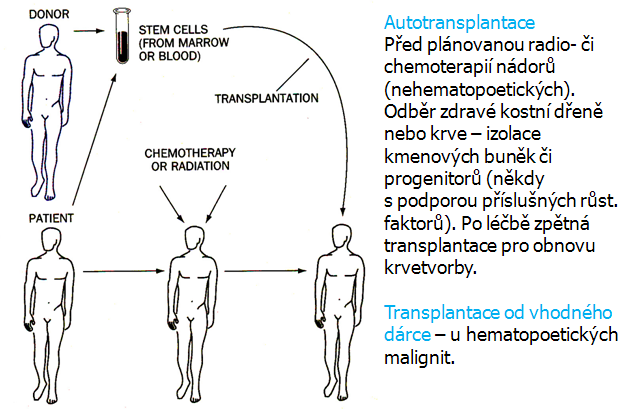
Obr. 12-27 Transplantace
(Christiansen J.C., Scientific American 1996 : 124)
MDS jako získaná klonální porucha kostní dřeně charakterizovaná kvantitativními i kvalitativními poruchami v hemopoéze je diagnostikována zejména u starších lidí. Není proto možné použít drastickou terapii a transplantace. Standardizovaná terapie zde neexistuje.
Řada léčebných protokolů je zaměřena na využití diferenciačních látek k podpoře zrání blokovaných buněk. Existují modely in vitro, kde je možno navodit diferenciaci buněk pomocí analogů kyseliny retinové, dimetylsulfoxidu nebo vitaminu D3, glukokortikoidů, IFN, příp. G-CSF, GM-CSF (obr. 12-28). Přestože experimentální výsledky jsou nadějné, u pacientů nepřinášejí tyto metody žádoucí výsledky.

Obr. 12-28 Diferenciace myeloidních leukemických buněk do nemaligních zralých makrofágů nebo granulocytů interleukinem-6
(Saachs L., Eur J Cancer 1994 : 852)
All-trans retinová kyselina (ATRA) je nyní efektivním lékem při léčbě akutní promyelocytární leukémie. Na MDS má však malý účinek, což má pravděpodobně genetický důvod a to absenci translokace 15,17, jejíž přítomnost je pro klinický účinek ATRA důležitá.
Rekombinantní růstové faktory jako GM-CSF a IL-3 jsou u MDS pacientů úspěšně využívány ke zvýšení počtu cirkulujících bílých krvinek a destiček.
Pozorování předpokládají, že MDS je způsobena defektním diferenciačním programem, ale progrese do AML vyžaduje další abnormalitu, která poskytne růstovou stimulaci, jako je autokrinní produkce růstového faktoru nebo konstitutivní aktivace receptoru pro růstový faktor. Identifikace řady protoonkogenů jako jsou růstové faktory nebo jejich receptory a důležité účinky těchto proteinů na hematopoetické buňky vedly k hledání deregulace těchto molekul u leukémií.
Využití vysokých dávek chemoterapeutik, které účinně působí na citlivé nádory je omezeno vedlejšími účinky s hematologickou toxicitou. Jednou z cest jak překonat tyto obtíže je metoda transplantace kmenových buněk z periferní krve (PBSC), která je alternativou k transplantaci kostní dřeně a je stále více využívána. Má řadu výhod: sběr PBSC leukaferézou probíhá mimo pacienta bez potřeby anestézie a možností autograftu v případě ovlivnění kostní dřeně infiltrací nádoru, fibrózou nebo hypoplasií po chemo- a radioterapii. Navíc dochází k rychlejšímu obnovení granulocytopoézy a megakaryocytopoézy a k redukované možné kontaminaci transplantantu maligními buňkami. Odhad je, že v kostní dřeni je asi 0.001 % pravých kmenových buněk, 10x víc multiliniových progenitorů a 100x víc liniově specifických progenitorů. U dospělců cirkuluje v periferní krvi asi 5–10 % počtu progenitorových buněk v kostní dřeni. Představují asi 0.1 % mononukleární frakce periferní krve.
Byly vyvinuty metody zvýšení cirkulujících progenitorů aplikací specifických cytokinů. CD34 je glykosylovaný povrchový antigen exprimovaný především kmenovými a méně progenitorovými buňkami. Byla vyvinuta řada metod pro selekci buněk s tímto znakem CD34+. S vývojem metod kultivace in vitro lze tyto buňky namnožit s pomocí synergického působení kombinace cytokinů (steel faktor + další) a pak pomocí reinfuze aplikovat pacientům. Tyto buňky je též možné využít in vitro k označení genů a genové terapii.
Cílem terapie s využitím imunomodulačních látek je ovlivnění imunitního systému hostitele k podpoře boje proti nádoru. Cílové buňky pro imunomodulaci mohou patřit k lymfatickému systému, ale v protinádorovém boji hraje důležitou roli i monocytární-makrofágový systém. GM-CFC, M-CFC nebo IL-3 stimulují cytotoxicitu makrofágů in vitro. G-CSF a IL-8 stimulují funkce neutrofilů např. u MDS.
Interferony (např. IFN alfa, gamma) vykazují regulační aktivitu u řady maligních poruch. Klinická aplikace IFN alfa na multičetné myelomy není zcela jednoznačná, malé dávky však působí na tzv. vlasaté leukemie.
Interleukin -2 je schopen tvořit tzv. lymfokinem aktivované zabíječe (LAK), které mají širší spektrum cílových buněk než NK nebo cytotoxické T buňky. Tato metoda objevená v 80. letech byla zkoušena nejdříve na myších, později i na pacientech. Lymfocyty izolované z krve pacientů je možné kultivovat in vitro s IL-2 a tyto stimulované LAK transplantovat zpětně pacientovi (obr. 12-29). Kromě toho byla zkoušena i metoda mimotělní kultivace, kdy tzv. TIL‘S (tumor-infiltrating lymphocytes) vyžadují víc než měsíc přípravy před aplikací pacientům. Ze vzorku nádoru jsou vykultivovány TILs, namnoženy s IL-2 a zpětně transplantovány pacientům (obr. 12-30). Tyto metody však nenašly širší využití.
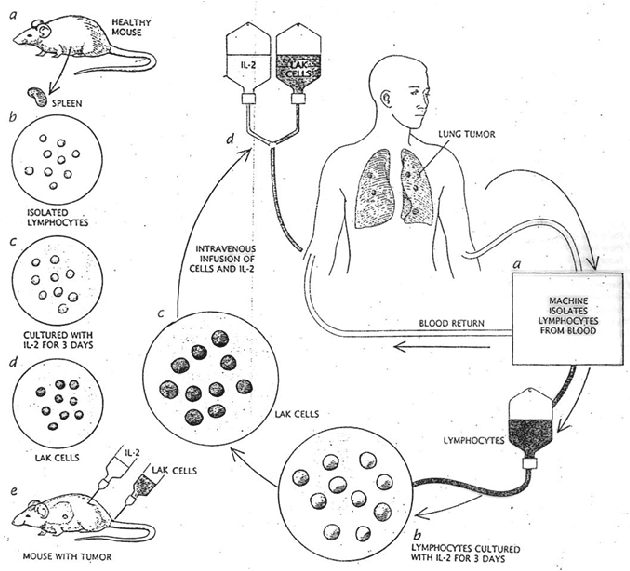
Obr. 12-29 Využití LAK (lymphokine-activated killer) buněk v protinádorové terapii
(Rosenberg S.A. et al., Int Natl Cancer Inst 1993 : 622)
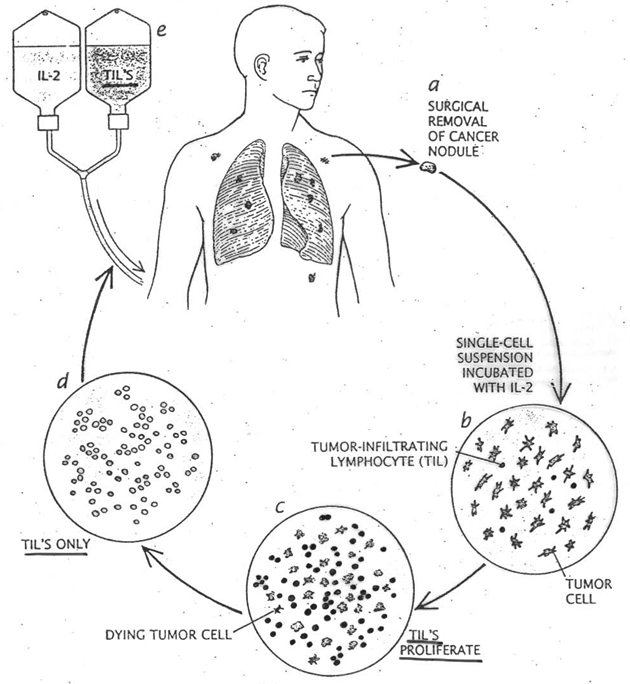
Obr. 12-30 TIL‘S (tumor-infiltrating lymphocytes) vyžadují víc než měsíc přípravy před aplikací pacientům
(Rosenberg S.A. et al., Int Natl Cancer Inst 1993 : 622)
Cytokiny mohou kromě samostatných účinků působit také biomodulaci cytotoxických látek. Biomodulace je definována jako zvýšení protinádorové aktivity manipulací metabolických cest cytostatických látek sekundárními biomodulačními látkami, které samy mají malou nebo žádnou antiproliferační aktivitu (např. INF alfa zvyšuje účinnost 5-fluorouracilu u gastrointestinálních malignit).
Kontrolní otázky k tématu
Jaká je charakteristická organizace sebeobnovných buněčných populací? Uveďte příklady.
Jak je organizována krvetvorná tkáň? Jmenujte základní krvetvorné řady.
Uveďte příklady patologických poruch krvetvorby.
Jak je charakterizována leukémie?
Jaká je úloha stromatu kostní dřeně v regulaci krvetvorby?
Charakterizujte preleukemické poruchy.
Jak dochází ke zvratu v akutní leukémii?
Charakterizujte základní 2 typy akutní leukémie.
Co jsou to lymfomy?
Jaké metody se používají k diagnostice onemocnění a úspěšnosti léčby poruch krvetvorby?
Jak jsou využívány poznatky o působení cytokinů a růstových faktorů v léčbě leukémií?
Které konkrétní cytokiny či růstové faktory a k čemu se využívají?
Co znamená diferenciační terapie?
V čem spočívá metoda transplantace a které typy buněk se transplantují?
V čem spočívá využití imunomodulačních látek?
Co je to biomodulace?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

