Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Angiogeneze
Angiogenezí nazýváme proces tvorby nových krevních kapilár. U dospělého jedince je proliferace endoteliálních buněk velmi nízká. Fyziologickou výjimku, kde je ale angiogeneze přísně regulována, tvoří ženský reproduktivní systém a hojení ran. Neregulovaná angiogeneze je spojena s řadou patologických stavů jako je revmatická artritida, psoriasis (lupénka), diabetická retinopatie a nádorová onemocnění.
Nádorový růst a tvorba metastáz jsou závislé právě na angiogenezi. Rostoucí nádor potřebuje rozsáhlou síť kapilár k zásobování živinami a kyslíkem. Kromě toho jsou kapiláry uvnitř nádorů cestou, kudy se nádorové buňky dostávají do oběhu a mohou tak metastázovat v různých vzdálených orgánech. Angiogeneze je opět komplexní proces zahrnující širokou souhru mezi buňkami, rozpustnými faktory a složkami ECM (obr. 11-1).
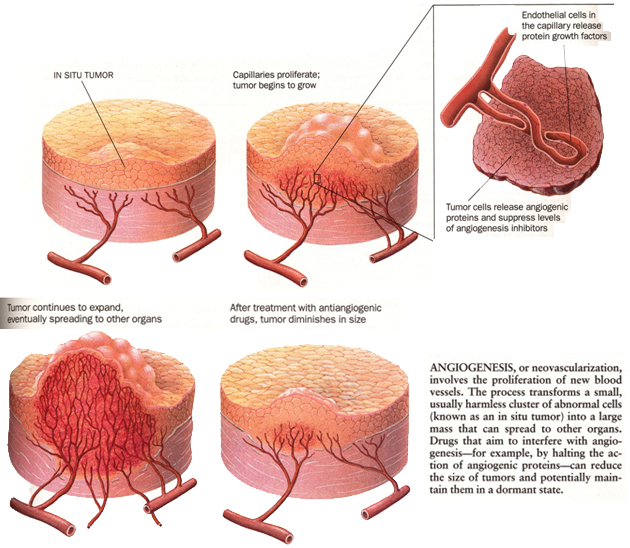
Obr. 11-1 Angiogeneze
(Folkman J., Scientific American 1996 : 150)
K zahájení tvorby nových kapilár musí endoteliální buňky stávajících cév degradovat bazální membránu a vniknout do stromatu sousedních tkání. Tento proces invaze a migrace vyžaduje opět kooperativní aktivitu PA a MMP. Po proteolytické degradaci zahajují „vedoucí“ endoteliální buňky migraci přes degradovanou matrix. Jsou následovány proliferujícími endoteliálními buňkami, které jsou stimulovány řadou faktorů, z nichž některé jsou uvolňovány z degradované ECM.
Induktory angiogeneze
Hlavní endogenní induktory angiogeneze představují různé peptidové růstové faktory a prozánětlivé mediátory (obr. 11-2):
- Rodina vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor – VEGF) a angiopoetiny působí specificky na endoteliální buňky. VEGF působí protiapopticky a aktivuje receptorové tyrozin kinázy. Jeho hladina je zvyšována hypoxií.
- Přímo působící cytokiny a chemokiny, které aktivují řadu dalších buněčných typů. Prototypem je bazální fibroblastový růstový faktor (basic fibroblast growth factor – bFGF), růstový faktor destiček (platelet growth factor – PDGF) a dále interleukiny (IL-8, IL-3).
- Nepřímo působící faktory jako je nádor nekrotizující faktor (tumor necrosis factor – TNF alpha) a transformující růstový faktor (transforming factor – TGF beta), které působí parakrinně uvolňování dalších faktorů z makrofágů, endoteliálních nebo nádorových buněk. Např. TNF alpha stimuluje uvolňování VEGF, IL-8 a FGF-2 z endoteliálních buněk.
- Enzymy (cyklooxygenáza-2 – COX2, angiogenin), hormony (estrogeny), oligosacharidy (hyaluronan), hemopoetické faktory (erytropoetin – EPO, granulocytární růstový faktor – G-CSF, granulocytární monocytární růstový faktor – GM-CSF), adhezívní molekuly (VCAM-1, E-selektin), oxid dusíku atd.
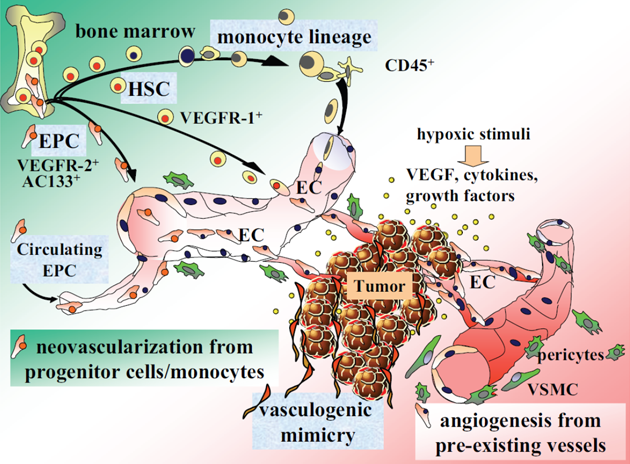
Obr. 11-2 Patologická neovaskularizace během nádorové progrese
(Furuya M. et al., Vascular Health and Risk Management 2005 : 277)
Jako endogenní inhibitory angiogeneze působí trombospodin-1, interferon α/β, prolactin a tzv. statiny (angiostatin, endostatin, vasostatin atd.)
Zahájení nádorové angiogeneze je výsledkem posunu v rovnováze stimulátorů a inhibitorů.
Úloha buněčné adheze v angiogenezi
Proces buněčné invaze, migrace a proliferace není závislý jen na angiogenních enzymech, růstových faktorech a jejich receptorech, ale je zprostředkován také adhezívními molekulami. V angiogenezi se uplatňují členové každé skupiny CAM.
K zahájení angiogenního procesu se musí endoteliální buňky uvolnit od sousedních buněk. Během invaze a migrace je pak interakce endoteliálních buněk s ECM zprostředkována integriny. Také konečná fáze angiogenního procesu, včetně konstrukce kapilárních smyček a určení polarity buněk, vyžaduje buněčné kontakty a kontakty s ECM (obr. 11-3).
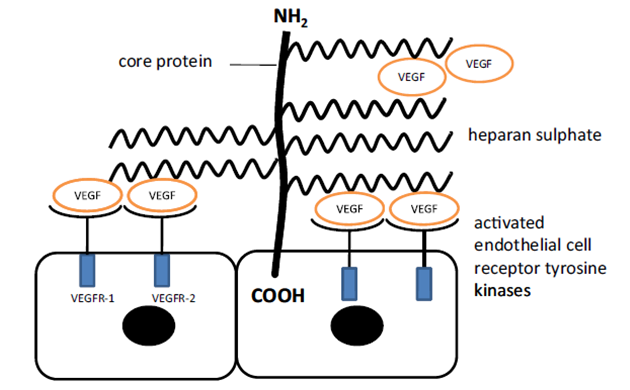
Obr. 11-3 Interakce heparan sulfátu (HS) s VEGF na receptorech endoteliálních buněk během angiogeneze
(Rambaruth N.D.S. a Dwek M.V., Acta Histochemica 2011 : 591)
Endoteliální buňky tak exprimují několik různých integrinů, což jim umožňuje napojení na široké spektrum proteinů ECM. Některé integriny jsou nedetekovatelné v klidovém endotelu, ale jsou zvýšeny během angiogeneze indukované cytokiny nebo nádorem. V aktivovaném endotelu mohou potlačovat aktivitu p53 a p21 a zvyšovat poměr Bcl2:Bax, což má antiapoptické účinky.
Kromě integrinů se v angiogenezi uplatňuje i řada dalších molekul:
- vaskulární endoteliální kadherin zprostředkovává homofilní interakce mezi endoteliálními buňkami závislé na Ca2+;
- členové ICAM zprostředkovávají heterofilní adheze. Jsou zvyšovány TNF alfa, IL-1 nebo interferonem-gamma;
- P- nebo E-selektin podporují adhezi leukocytů k endotelu aktivovanému cytokiny.
V angiogenezi se uplatňují rovněž interakce řady buněčných typů (obr. 11-4). V nádorových buňkách prostaglandiny (PGs) tvořené přes COX-2 zvyšují produkci růstových faktorů jako je VEGF, které působí přímo na endoteliální buňky a bFGF, který stimuluje produkci COX-2 u fibroblastů. PGs tvořené ve fibroblastech stimulují produkci VEGF, který působí parakrinním způsobem na endoteliální buňky a opět zvyšuje aktivitu COX-2 a usnadňuje permeabilitu cév a angiogenezi. Inhibitory COX-2 blokují produkci PGs a tak zabraňují angiogenezi indukované růstovými faktory.
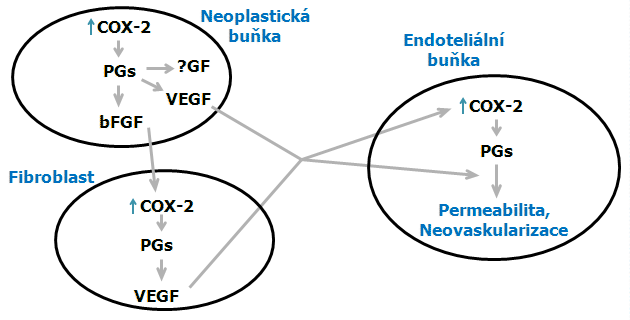
Obr. 11-4 Model angiogeneze – interakce buněčných typů
(podle Leahy K.M. et al., Curr Med Chem 2000 : 163)
Význam angiogeneze a antiangiogenní terapie
Existuje úzký vztah mezi angiogenezí a tvorbou metastáz. Čím intenzívnější angiogeneze, tím větší riziko metastáz a horší prognóza nádorového onemocnění. Hustota cév uvnitř nádoru má také prognostickou hodnotu. Byla nalezena pozitivní korelace mezi nádorovou angiogenezí a rizikem vzniku metastáz, znovuobnovením nádoru a smrtí. Kvantitativní hodnocení je prognostickým faktorem např. u rakoviny prsu, děložního čípku, močového měchýře a melanomu. Zvýšená vaskularizace kostní dřeně značí horší prognózu u akutní leukémie. Z histologických řezů se detekují fokální oblasti tzv. „hot spots“ pomocí monoklonálních protilátek proti cévnímu endotelu nebo adhezívním molekulám CD31 a CD34.
Odhalování molekulární a buněčné biologie angiogeneze dává základ pro nové terapeutické přístupy, které využívají řadu anti-angiogenních látek specifických pro jednotlivé kroky angiogeneze. V současnosti existuje řada protinádorových chemoterapeutických látek. Bohužel, mnohé mají omezenou účinnost díky problémům s doručením a pronikáním k buňkám a díky malé selektivitě pro nádorové buňky, čímž způsobují vážné poruchy v normálních tkáních. Jejich aktivita je omezena také vývojem rezistence. Nádorové buňky se rychle mění díky své genomové nestabilitě, heterogenitě a vysoké mutační rychlosti, což vede k selekci a přerůstání rezistentní nádorové populace.
Antiangiogenní terapie, která zasahuje aktivované endoteliální buňky, poskytuje řadu výhod proti terapii mířené přímo proti nádorovým buňkám. Endoteliální buňky jsou geneticky stabilní, diploidní a homogenní cíl a zřídka zde dochází k mutacím. Také jejich obnova je až padesátkrát vyšší než v normální klidové tkáni a aktivované krevní cévy vykazují specifické markery, jako jsou integriny a selektiny nebo VEGF receptory.
K potenciálně využitelným látkám patří (obr. 11-5):
- Inhibitory buněčné invaze, motility a adheze (inhibitory MMP aktivity, inhibice buněčných adhezívních molekul).
- Inhibitory aktivovaných endoteliálních buněk jako je trombospodin-1, fyziologický inhibitor angiogeneze, který je snížen během aktivace angiogeneze a jeho produkce je regulována p53. Dále různé typy statinů jako je angiostatin a endostatin, jejichž zdrojem jsou samotné nádorové buňky i uměle syntetizované látky (talidomid).
- Látky, které interferují s angiogenními růstovými faktory a jejich receptory (specifické protilátky, INF-alfa).
- Inhibitory enzymů jako je COX-2 (nesteroidní protizánětlivé látky – NSAIDs).
Specifickým přístupem je tzv. „vascular targeting“, tj. inhibice růstu nádoru destrukcí nádorových cév. Problémem je nedostatek specifických markerů pro aktivované nádorové endotelium. Potenciální cílové molekuly zahrnují integriny, E-selektin a receptory pro VEGF. Destrukce může být dosaženo lokálním dodáním specifických peptidů nebo protilátek s přímou biologickou aktivitou nebo konjugované s toxiny (obr. 11-6).
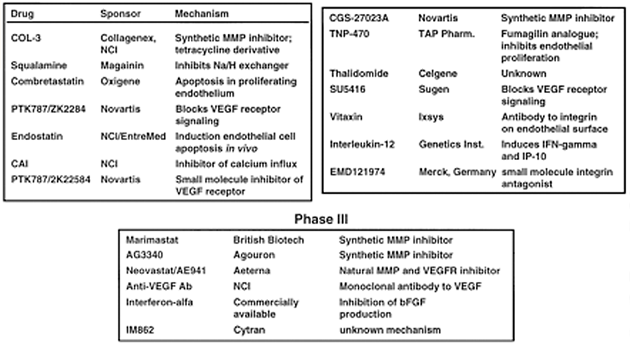
Obr. 11-6 Inhibitory angiogeneze v klinických zkouškách
Kontrolní otázky k tématu
Co je to angiogeneze a jaký je její význam pro růst nádorů?
Vyjmenujte skupiny látek (faktorů) patřící mezi induktory angiogeneze.
Jaké látky fungují jako inhibitory angiogeneze?
Jakým způsobem se v angiogenezi uplatňují adhezívní molekuly?
Jakým způsobem funguje během angiogeneze interakce různých buněčných typů – příklad?
Jak souvisí angiogeneze s tvorbou metastáz?
Jak jsou využívány poznatky o mechanizmech angiogeneze v terapii?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041


